
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Використання законів Вант-Гоффа та Рауля до розчинів електролітів
Дослідження осмотичного тиску, температур кипіння та замерзання розчинів електролітів свідчать, що ці розчини не підлягають законам Вант-Гоффа та Рауля. Експериментально отримані значення 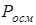 ,
, 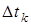 ,
, 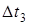 для розчинів електролітів завжди були більші значень, розрахованих за формулами Вант-Гоффа та Рауля. Причиною цього є зростання загальної кількості частинок у розчині внаслідок електролітичної дисоціації молекул солей, основ та кислот.
для розчинів електролітів завжди були більші значень, розрахованих за формулами Вант-Гоффа та Рауля. Причиною цього є зростання загальної кількості частинок у розчині внаслідок електролітичної дисоціації молекул солей, основ та кислот.
Властивості розчинів (осмотичний тиск, температура кипіння та замерзання) кількісно залежать тільки від кількості частинок розчиненої речовини і не залежать від їх природи.
Наприклад, у розбавленому розчині 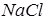 кожна молекула дисоціює на два іони:
кожна молекула дисоціює на два іони:
 ,
,
отже, число частинок у цьому розчині в два рази більше, ніж число розчинених молекул. Для того, щоб закони Вант-Гоффа і Рауля можливо було використати для розбавлених розчинів електролітів, значення концентрації розчиненої речовини потрібно помножити на коефіцієнт 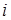 . Цей коефіцієнт має назву ізотонічного або коефіцієнта Вант-Гоффа.
. Цей коефіцієнт має назву ізотонічного або коефіцієнта Вант-Гоффа.
Тоді формули будуть мати наступний вигляд:
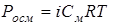 ,
, 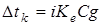 ,
,  .
.
Для розчинів неелектролітів ізотонічний коефіцієнт 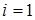 .
.
Ізотонічний коефіцієнт дорівнює відношенню загального числа часток 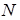 у розчині до числа розчинених молекул
у розчині до числа розчинених молекул 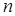 :
:
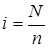 .
.
Ізотонічний коефіцієнт певним образом пов’язаний зі ступінню дисоціації електроліта 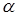 :
:
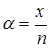 ,
,
де 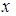 - число молекул, які розпалися на іони;
- число молекул, які розпалися на іони; 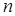 - число розчинених молекул.
- число розчинених молекул.
Тоді
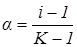 ,
,
де 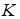 - кількість іонів, на які розпадається одна молекула електроліта:
- кількість іонів, на які розпадається одна молекула електроліта:
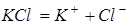
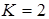 ;
;
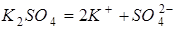
 ;
;
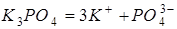
 .
.
Для сильних електролітів у розбавлених розчинах 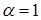 , тому що всі молекули розпадаються на іони.
, тому що всі молекули розпадаються на іони.
В більш концентрованих розчинах іони взаємодіють між собою, що призводить до результатів, котрі спостерігались би при неповній дисоціації електролітів. У зв’язку з цим ввели величину – уявна ступінь дисоціації електролітів. Ця величина така ж, як ступінь дисоціації слабкого електроліта, позначається літерою 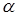 і входить у ті ж рівняння та формули.
і входить у ті ж рівняння та формули.
Приклад 1. Розчин, який містить 1,06 г  у 400 г води, замерзає при температурі – 0,13°С. Визначити уявну ступінь дисоціації солі,
у 400 г води, замерзає при температурі – 0,13°С. Визначити уявну ступінь дисоціації солі, 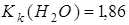 .
.
Розв’язування.  - сіль, отже це сильний електроліт. Тому для розв’язання задачі потрібно вкористати другий закон Рауля у такій формі:
- сіль, отже це сильний електроліт. Тому для розв’язання задачі потрібно вкористати другий закон Рауля у такій формі:
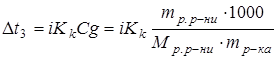 ;
;
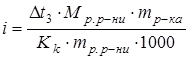 ;
;
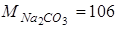 г/моль;
г/моль;  ;
;
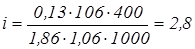 .
.
Значення ізотонічного коефіцієнта використовуємо для розрахунку ступіня електролітичної дисоціації. Дисоціація карбонату натрію проходить з утворенням трьох іонів з однієї молекули:
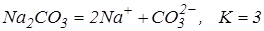 ;
;
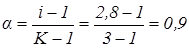 .
.
Уявна ступінь дисоціації a дорівнює 0,9, тобто 90%.
Приклад 2. Уявна ступінь дисоціації 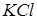 в 0,1 н. розчині дорівнює 0,8.
в 0,1 н. розчині дорівнює 0,8.
Яким буде осмотичний тиск цього розчину при 17°С?
Розв’язування. Хлорид калію – сіль, отже сильний електроліт, при дисоціації однієї молекули утворюється два іони:
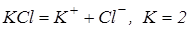 .
.
Обчислюємо ізотонічний коефіцієнт:
 ;
;
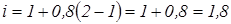 .
.
Тоді осмотичний тиск за законом Вант-Гоффа буде:
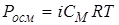 .
.
Для солі 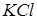 маса еквівалента дорівнює масі 1 моля, тому
маса еквівалента дорівнює масі 1 моля, тому
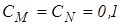 моль/л;
моль/л;
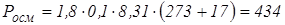 кПа.
кПа.
| <== попередня сторінка | | | наступна сторінка ==> |
| Підвищення температури кипіння та зниження температури замерзання розчинів | | | Задачі для самостійного розв’язування |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |