
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції в розчинах електролітів
Необхідно пам’ятати, що реакції в розчинах електролітів фактично проходять між іонами і супроводжуються утворенням осадів, виділенням газів або утворенням інших малодисоційованих молекул. Тому при написанні іонно-молекулярних рівнянь хімічних реакцій необхідно враховувати ступінь дисоціації і розчинність речовин. У вигляді іонів записують лише сильні електроліти, а слабкі електроліти, газоподібні леткі продукти і нерозчинні (слабко-розчинні) сполуки – в молекулярній формі.
Приклад 1. Написати в молекулярній і іонній формах рівняння взаємодії гідроксиду міді із сірчаною кислотою.
Розв’язання. В молекулярній формі
Сu(OH)2+H2SO4=CuSO4+2H2O
В іонній формі
Сu(OH)2+2H+= Cu2++2H2O
Реакцію середовища будь-якого водного розчину встановлюють за значенням водневого показника рН, десятковим логарифмом концентрації іонів водню в розчині, взятим із протилежним знаком.
рН=- lg[H+]
Аналогічно
рОН=- lg[ОH-]
Для розбавлених розчинів рН+рОН=14 при температурі 22°С.
Приклад 2. Визначити рН розчину соляної кислоти, якщо С(HCl)=0,01 моль/л.
Розв’язання. Визначаємо концентрацію іонів водню
[H+]=С · n ·a, ( 1 )
де: С – молярна концентрація кислоти, моль/л; п – число іонів водню, що утворюються із однієї молекули кислоти; a - ступінь дисоціації, в частках одиниці.
Для соляної кислоти (НСl=H++Cl-), n=1; a=1.
Концентрація іонів водню
[H+]=0,01×1×1=10-2 моль/л
рН=- lg10-2=2
Приклад 3. Визначити рН розчину H2SO4, якщо С(H2SO4)=0,01 моль/л, а a=75%.
Розв’язання. Визначаємо концентрацію іонів водню на підставі (1)
[H+]=Спa=0,01×2×0,75=1,5×10-2 моль/л
рН= - lg1,5×10-2=1,82
Приклад 4. Визначити рН водного розчину NaOH, якщоС(NaOH)=0,05 моль/л, а a=100%.
Розв’язання. Визначаємо концентрацію OH— іонів.
[ОH-]=0,05×1×1=5×10-2 моль/л
рОН=- lg5×10-2=1,3; рН=14-1,3=12,7
Для швидкого і наближеного визначення рН різних розчинів користуються індикаторами, що змінюють своє забарвлення в окресленому інтервалі рН. Найважливішими індикаторами є лакмус, метилоранж і фенолфталеїн.
Точні значення рН розчину можна дістати за допомогою спеціальних приладів - рН-метрів.
Для характеристики розчинності малорозчинних сполук використовують величину, яку називають добутком розчинності ДР:
ДР(КmAn) = [Kn+]m·[Am-]n
Гідроліз солей – обмінна реакція речовини з водою, яка приводить до утворення малорозчинних або малодисоційованих сполук (основи, кислоти, основних або кислих солей).
Необхідно добре пам’ятати:
1) гідроліз солей – процес оборотний і характеризується константою гідролізу Kг;
2) гідролізу підлягають солі утворені:
а) сильною основою і слабкою кислотою;
б) слабкою основою і сильною кислотою;
в) слабкою основою і слабкою кислотою;
3) солі, утворені сильною основою і сильною кислотою, а також солі, нерозчинні у воді, гідролізу не підлягають.
Приклад 5. Скласти рівняння гідролізу карбонату натрію Na2CO3.
Розв’язання. Сіль Na2CO3 утворена сильною основою NaОН і слабкою кислотою Н2CO3. Гідроліз буде протікати по аніону. Запишемо рівняння реакції гідролізу цієї солі:
а) дисоціація солі
Na2CO3= 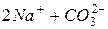
б) гідроліз аніона
І ступінь: 
ІІ ступінь: 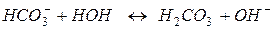
Отже, розчини солей, що складаються з аніонів слабких кислот і катіонів сильних основ, гідролізують з утворенням слабкої кислоти або кислої солі. Розчини таких солей мають лужну реакцію.
Приклад 6. Скласти рівняння реакцій гідролізу солі FeCl3.
Розв’язання. Сіль FeCl3 утворена слабкою основою Fe(ОН)3 і сильною кислотою НСl. Гідроліз буде протікати по катіону. Процес дисоціації FeCl3 відбувається так:
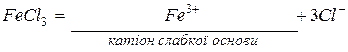
Гідроліз катіона 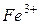 проходить за схемою:
проходить за схемою:
І ступінь: Fe3++HOH ↔ Fe(OH)2++H+
ІІ ступінь: 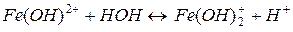
ІIІ ступінь: 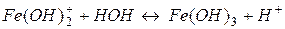
При кімнатній температурі процес гідролізу Fe3+ йде за першим ступенем. За третім ступенем гідроліз цієї солі може йти лише при кип’ятінні.
Таким чином, солі слабких основ і сильних кислот гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. При цьому утворюється вільна сильна кислота, а розчини таких солей мають кислу реакцію (рН<7).
Приклад 7. Складіть рівняння гідролізу ацетату амонію CH3COONH4.
Розв’язання. Внаслідок дисоціації цієї солі
CH3COONH4 = CH3COO -+ 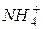
утворюється аніон слабкої кислоти і катіон слабкої основи, які гідролізуються за схемою:
CH3COO -+HOH↔ CH3COOH+OH -
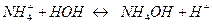
Розчин такої солі внаслідок її гідролізу може мати такі значення рН: 7, >7, <7. Ці значення визначаються константою дисоціації сильнішого електроліту (кислоти або основи). В нашому випадку розчин має рН=7, оскільки константи дисоціації гідроксиду амонію і оцтової кислоти практично однакові

Необхідно знати, що гідролізують не всі молекули, які є в розчині, а лише їх частина. Кількісно гідроліз оцінюють за ступенем і константою гідролізу.
Ступінь гідролізу h - це відношення кількості прогідролізованої солі (Сгідр), до загального числа розчинених молекул (Сзаг).
Константа гідролізу Кг – константа рівноваги реакції гідролізу, її значення не змінюється при сталій температурі
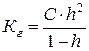
Ступінь гідролізу, як правило, невеликий і в 0,1 М розчині CH3COONa і в 0,1 М розчині NH4Cl при температурі 298 К складає біля 10-4, тобто в цих розчинах гідролізується лише одна молекула із 10000. В той самий час у гарячих розчинах гідроліз може настільки підсилитися, що пройде повний розклад солі. Це спостерігається зокрема для розчину FeCl3, в якому при нагріванні виділяється Fe(ОН)3 у вигляді колоїдних частинок.
Гідроліз деяких солей, утворених дуже слабкими кислотами, є процес необоротний, наприклад, гідроліз сульфідів і карбонатів алюмінію, хрому й заліза.
Fe2S3+6H2O=2Fe(OH)3+3H2S
Тому при взаємодії солей, що мають іони Al3+, Fe3+, Cr3+ з розчинами сульфідів і карбонатів, в осад випадають не сульфіди і карбонати цих катіонів, а їх гідроксиди.
2AlCl3+3Na2S+6H2O=2Al(OH)3¯+3H2S+6NaCl
Розчини електролітів такої самої концентрації, що й розчини неелектролітів, замерзають при нижчих температурах і киплять при вищих температурах, ніж розчини неелектролітів. При обчисленні температури замерзання й температури кипіння розчинів електролітів необхідно застосовувати такі рівняння:
Dtзам=iKкрCm; (2)
Dtкип=iKебCm; (3)
де i - ізотонічний коефіцієнт, або коефіцієнт Вант-Гоффа. Він показує, у скільки разів більше частинок електроліту утворилося у розчині порівняно з кількістю вихідних і описується відношенням:
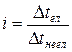 (4)
(4)
Ізотонічний коефіцієнт можна також визначити за рівнянням
i=1+a(n-1), (5)
де n – число іонів, що утворюються при дисоціації однієї молекули електроліту.
Приклад 8. Визначити температуру замерзання 5%-го розчину Na2SО4, якщо a=90%.
Розв’язання. Згідно з рівнянням (5)
i=1+0,9(3-1)=2,8;
 моль/кг.
моль/кг.
Тоді Dtзам=iKкрCm=2,8×1,83×0,37=1,93. Отже, температура замерзання розчину дорівнює -1,9°С.
Переглядів: 1730