
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Целюлази, пектинази
План
Тема 7
Продуктах
Методи визначення кислот у харчових
До методів визначення кислот відносяться стандартні методи: колориметричний і електрометричний.
Визначення потенційної кислотності основане на титруванні цих речовин лугом.
Для різних харчових продуктів характерні свої особливі умови титрування результати яких подають у відповідних кислотних числах.
Аналіз кислотного складу харчового продукту дає можливість виявити фальсифікацію чи підтвердити натуральність.
Органічні кислоти визначають стандартними і альтернативними методами.
Так, молочну кислоту визначають шляхом її окиснення перманганатом калію до оцтового ангідриду, який визначається йодометрично.
Винну кислоту визначають лужним титруванням винного каменю, що випадає в осад.
Більшість органічних кислот можна визначити хроматографічним методом.
До альтернативних відносяться методи основані на використанні ферментативних систем. Особливості цього методу є специфічність, яка забезпечує достовірність, точність результатів і чутливість.
Питання для самоперевірки
1. Дайте загальну характеристику кислот, що входять до складу харчових продуктів.
2. Наведіть приклади речовин, що використовуються у харчовій промисловості для регулювання рН харчових систем.
3. В яких технологічних функціях проявляється дія органічних кислот у харчових системах?
4. Які особливості органічних кислот, що використовуються у харчових цілях?
5. Приведіть приклади біохімічних змін кислотності харчової системи.
6. Дайте коротку характеристику методів, які дозволяють визначити кислоти у складі продуктів.
7. На які технологічні параметри впливає величина рН?
Рекомендована література
Основна:
1. с.263 – 275
роль Ферментів та ферментних препаратів у
харчових технологіях
1. Класифікація ферментів, їх властивості
2. Фактори, що впливають на кінетику ферментативних реакцій
3. Основні біохімічні перетворення у харчових технологіях
4. Ферментні препарати, їх характеристика
5. Застосування ферментних препаратів у харчових технологіях
1. Класифікація ферментів, їх властивості
Ферменти – це біологічні каталізатори білкової природи. Вони значно перевищують швидкість хімічних реакцій. Вступаючи в біохімічні реакції, ферменти не витрачаються і не зазнають незворотних змін.
Ферментативну реакцію можна представити таким рівнянням:
Е + S ÛES → P + E,
де Е – фермент, S – субстрат, ЕS – фермент-субстратний комплекс, Р – продукт реакції.
Ферменти як білкові речовини часто зв’язані з небілковим компонентом – коферментом, який бере участь у дії ферменту. Коферментом можуть бути вітаміни, їх похідні та інші речовини.
Класифікація ферментів
| Клас | Назва класу | Реакціі, що каталізуються |
| Оксидоредуктази | Окисно-відновні реакції (приєднання О2, відщеплення та перенесення Н2) | |
| Трансферази | Перенесення атомних груп з однієї сполуки на іншу | |
| Гідролази | Реакції гідролізу | |
| Ліази | Реакції негідролітичного відщеплення або приєднання груп по місцю подвійного зв’язку | |
| Ізомерази | Реакції ізомерації |
Харчові технології є, по-суті, біотехнологіями, оскільки одними з найбільш важливих процесів є мікробіологічні та біохімічні. Біохімічні процеси, що мають місце під час зберігання сировини та під час перебігу технологічних процесів, пов'язані з дією природних, власних ферментів харчової сировини, ферментів мікроорганізмів, а також ферментів, які вносяться у напівфабрикати у вигляді ферментних препаратів.
Особливіості ферментів порівняно з неорганічними каталізаторами:
1. Вони значно, в 108– 1020, підвищують швидкість реакцій, що каталізуються;
2. Дія ферментів є специфічною, тобто, вони каталізують лише певні реакції і можуть діяти на один субстрат, на групу споріднених субстратів, або на певні зв'язки, або на певні стереохімічні форми субстратів;
3. Ферменти як біологічні каталізатори є лабільними, тобто вони змінюють свою активність під впливом рН середовища, температури, вологості, присутності активаторів чи інгібіторів.
2. Фактори, що впливають на кінетику
ферментативних реакцій
Швидкість реакції залежить від:
1. Концентрації субстрату. Максимальна швидкість ферментативної реакції спостерігається при такій концентрації субстрату, коли всі активні центри ферменту насичені субстратом і перейшли в комплекс ES. Тобто, до певної межі збільшення концентрації субстрату сприяє зростанню швидкості реакції, а подальше збільшення концентрації не впливає на кількість продуктів реакції. При дуже високих концентраціях субстрат може навіть виконувати роль інгібітора.
2. Концентрації ферменту. Вона має суттєвий вплив на швидкість ферментативних реакцій. У разі насиченої концентрації субстрату, при якій V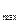 , початкова швидкість ферментативної реакції залежить від концентрації ферменту. Тобто, у разі надлишку субстрату швидкість тим вища, чим вища концентрація ферменту.
, початкова швидкість ферментативної реакції залежить від концентрації ферменту. Тобто, у разі надлишку субстрату швидкість тим вища, чим вища концентрація ферменту.
3. Природи субстрату та його атакованості. Атакованістю називають піддатливість субстрату до дії ферменту. Вона залежить від структури, розмірів молекули тощо. Наприклад, атакованість крохмалю амілазами залежить від розміру крохмальних зерен (чим він менший, тим більша атакованість, оскільки більша площа контакту субстрату і ферменту), від механічної зруйнованості (механічно пошкоджені крохмальні зерна мають вищу атакованість), клейстеризований крохмаль має вищу атакованість. Атакованість білка залежить від щільності білкової молекули, наявності –SH груп – чим їх більше, тим значніша атакованість.
4.Найбільш суттєвий вплив на активність ферментів має температура і рН середовища.
З підвищенням температури активність ферменту збільшується, досягає максимуму, а потім знижується. Оптимальна температура для більшості ферментів 40-50°С. Зниження активності ферментів при високій температурі є наслідком денатурації білка. Проте є термофільні ферменти, які мають значно вищий температурний оптимум і зберігають деяку активність навіть при нагріванні вище 100°С (наприклад, a- амілаза). Кожний фермент проявляє свою активність при різних межах рН. Деякі ферменти мають найбільшу активність у кислому середовищі, інші – у нейтральному чи лужному.
Параметри зони оптимуму дії основних ферментів зернових культур
| Фермент | рН | Температура, ºС |
| a-амілаза | 5,6...6,3 (кислотолабільна - інактивується при рН=3,3...4,0) | термостабільна (зберігає активність при 90ºС) |
| β-амілаза | 4,5...4,8 (кислотостабільна - зберігає активність при рН=3,3) | термолабільна (інактивується при температурах більше 60ºС) |
| Протеїназа | 4,0...4,8 | 40...50 |
| Ліпаза | 7,5...8,5 | 60...80 |
| Ліпоксигеназа | 6,0...7,0 | 20...30 |
| Поліфенолоксидаза | 5,0...7,0 | 40...50 |
| Целюлаза | 4,3...4,7 | 30...40 |
5.Швидкість ферментативних реакцій залежить від присутності активаторів. Цистеїн, глютатіон, які містять сульфгідрильні групи, є активаторами ферментів. Активуюча дія їх ґрунтується на тому, що вони відновлюють дисульфідні групи ферменту в сульфгідрильні, які є необхідними для відновлення ферментативної активності. При цьому самі активатори окислюються.
Інгібіторами ферментів можуть бути солі важких металів (Pb, Hg та ін.), трихлороцтова кислота тощо.
3.Основні біохімічні перетворення у харчових технологіях
У харчових технологіях основну роль відіграють гідролази та оксидоредуктази:
§ гідролази (гідролітичні ферменти) – ліпази, пектинестераза, амілази, b- галактозидаза, b- фруктофуранозидаза, протеїнази, целюлолітичні ферменти;
§ оксидоредуктази: поліфенолоксидаза, ліпоксигеназа, каталаза, пероксидаза.
.
Під час зберігання сировини ферменти беруть участь у:
§ гідролітичних процесах;
§ процесах дихання;
§ автолізі.
Значення гідролітичних процесів у харчових технологіях
Під час зберігання сировини гідролітичні процеси можуть викликати покращення якості або псування в залежності від умов зберігання. Наприклад, при зберіганні зимових сортів яблук, груш відбувається покращення їх смаку. Це пов¢язано з гідролізом крохмалю та з накопиченням цукрів, гідролізом пектинових речовин. Псування зерна відбувається при проростанні. Під час проростання ферменти активізуються, оскільки вони переходять із зв¢язаного стану у вільний стан.
Протеолітичні ферменти (протеази)
Білки підлягають хімічному (під дією кислот та лугів) та біохімічному (ферментативному) гідролізу. Кислотний та лужний гідроліз білків (розглянуто у темі 1) здійснюється при кип’ятінні з міцними кислотами та лугами. Кислотний та лужний гідроліз здійснюється в технологіях отримання білкових концентратів та ізолятів для переведення білків у розчинний з наступним виділенням білків з розчину шляхом висолювання. Підвищення кислотності тіста веде до часткової пептизації білків, тобто переходу їх у водорозчинний стан. Це може бути небажаним у разі перероблення борошна зі зниженими технологічними властивостями.
Ферментативний гідроліз білків здійснюється під дією протеаз, ферментів, які каталізують розрив пептидних зв’язків. Протеази поділяються на:
§ пептидази, які діють на пептидні зв’язки поліпептидів, гідролізуючи їх з утворенням амінокислот (екзопептидази);
§ протеїнази(папаїн, пепсин, трипсин), які діють на пептидні зв’язки білків, при цьому вони розщеплюють молекули білка на більш дрібні фрагменти, тобто під дією протеїназ відбувається лише деструкція білкової молекули (ендопептидази).
Вважається, що екзопептидази не можуть гідролізувати в середині молекули, а діють з карбоксильного чи з амінного кінця білкової молекули, відщеплюючи послідовно по одній молекулі амінокислоти.
Пептидази мають кислотний оптимум рНопт = 8 – 9, тому вони в тісті мало утворюють амінокислот.
Рослинні протеїнази є кількох типів:
- кислі з рНоп = 3,7 – 4,0;
- нейтральні з рНоп = 6,5 – 7,0;
- лужні з рНоп>8.
Найбільшої уваги заслуговують нейтральні протеїнази, оскільки вони в декілька разів активніші кислих протеїназ і в умовах тіста суттєво впливають на білки клейковини. У дозрілому зерні пшениці нейтральні протеїнази та їх білкові інгібітори утворюють неактивний комплекс, зв’язаний з клейковиною. Співвідношення активності протеїназ у зерні та їх інгібіторів визначає стабільність білкового комплексу, його поведінку під час тістоприготування. До активаторів кислих протеїназ відносяться глютатіон та цистеін, але нейтральні протеїнази не активуються глютатіоном та цистеїном. Нейтральні протеїнази знижують свою активність в присутності хлориду натрію, фенольних сполук, меланоїдинів. У залежності від активності протеїназ і стану клейковинного комплексу можна змінювати кількість та стадію внесення солі і цим самим впливати на активність протеолізу. Наприклад, під час перероблення борошна зі слабкого клейковиною її треба вносити якомога раніше наприклад, сіль в опару і в трохи більшій кількості, а у разі надмірно міцної клейковини сіль потрібно вносити на більш пізніх стадіях.
Ферментативний гідроліз білків має важливе значення в інших харчових технологіях.
Пепсин (кисла протеїназа) використовується для одержання казеїну молока і для розчинення білкової мутності у вині.
Реннін (схожий на пепсин) міститься в соці четвертого відділу шлунка телят, являє собою дуже потужну протеїн азу.
Поряд з рослинними та тваринними протеазами у харчових технологіях широко застосовуються протеази мікробного походження (грибні та бактеріальні).
Амілази
Ферментативний гідролізкрохмалювідбувається під дією амілолітичних ферментів a- і b-амілази, глюкоамілази та деяких інших.
a-амілаза є ендоамілазою, тобто вона може розривати внутрішньо-молекулярні зв’язки в будь-якому місці. Діючі на крохмалеві зерна, a-амілаза ніби розщеплює зерно, утворює на поверхні канали і бороздки. Клейстеризований крохмаль гідролізується з утворенням низькомолекулярних незабарвлюваних йодом декстринів, які дуже повільно гідролізуються a-амілазою до мальтози і глюкози.
крохмаль ® a -декстрини + мальтоза + глюкоза
b-амілаза є екзоамілазою, яка відщеплює від амілози і амілопектину мальтозу з нередукуючого кінця, діє лише на a-Д – 1,4 зв’язок. Нативні крохмальні зерна b-амілазою не гідролізуються. Клейстеризований крохмаль гідролізується на 54-58% до мальтози і 42-46% утворює b-декстринів.
крохмаль ® мальтоза + b декстрини
Глюкоамілаза a–1,4 глюканглюкогідролаза є екзоферментом, який каталізує послідовне відщеплення a-Д –глюкози від нередукеруючого кінця крохмального ланцюга. Особливістю цього ферменту є здатність швидко гідролізувати полімери, але дуже повільно ди-та олігосахара. Останніми роками у технології виробництва патоки поєднують кислотний і ферментативний гідроліз. Ферментативний гідроліз крохмалю має місце під час виготовлення пива та спирту.
Ферментативний гідроліз некрохмальних полісахаридів (целюлози, геміцелюлози, пектинів) здійснюється під дією ферментів целюлолітичного, геміцелюлолітичного і пектолітичного комплеків). Наприклад, у виробництві соків і у виноробстві – для освітлення та поліпшення умов фільтрування.
Пектинестераза гідролізує складноефірні зв’язки в молекулі розчинного пектину, в результаті чого утворюється галактуронова кислота і метиловий спирт.
Це призводить до зниження драглеутворюючої здатності пектину і супроводжується зниженням в’язкості. На цьому ґрунтується застосування пектин-естерази для освітлення плодових соків і вина.
Інвертаза (сахараза, b-фруктофуранозидаза)
Гідроліз сахарози у харчових технологіях може здійснюватись при нагріванні в присутності невеликої кількості кислот, зокрема, соляної. При цьому утворюється редукувальні цукри-глюкоза і фруктоза, які можуть приймати участь у процесах карамелізації, меланоїдиноутворення. В кондитерському виробництві використовується інвертний сироп, який готують шляхом кислотної інверсії розчину сахарози з концентрацією СР понад 80% і температурі близько 100°С, після чого кислоту нейтралізують розчином харчової соди NaHCO3. Інвертний сироп використовують при виробництві карамелі, мармеладу, як антикристалізатор замість патоки. Інвертний сироп крім глюкози і фруктози містить невелику кількість негідролізованої сахарози, а також продукти розкладу та конденсації сахарів, зокрема, забарвлюючі речовини. Інвертний сироп має високу гігроскопічність, що негативно впливає на якість карамелі.
Ферментативний гідроліз сахарози під дією фермента b-фруктофуранозидази (сахарази) має місце під час приготування тіста, під час виробництва вин: (сахароза гідролізується з утворенням зброджуваних цукрів глюкози і фруктози. Інвертний сироп, який використовується при виробництві безалкогольних напоїв, готують ферментативним способом.
Ліпаза
Гідроліз триацилгліцеринів відбувається під дією ферменту ліпази, при цьому утвоюються гліцерин і жирні кислоти. Реакція гідролізу широко застосовується в техніці для отримання жирних кислот, гліцерину, моно- і диацилгліцеринів. З іншого боку, негативне значення полягає у псуванні та зниженні якості продуктів, що містять ліпіди (жирів, зерна, круп, борошна ).
Глибина та інтенсивність процесу залежить від:
- хімічного складу ліпідів;
- супутніх речовин, що додаються чи утворюються, наприклад, антиоксиданти;
- вологості;
- активності ферментів ліпази;
- присутності мікроорганізмів;
- від контакту з повітрям;
- способу пакування.
На швидкість гідролізу впливає будова і положення ацилів. Зі збільшенням довжини вуглеводневого ланцюга та зі збільшенням ступеня ненасиченості жирних кислот швидкість гідролізу знижується. Швидкість гідролізу моноацилгліцеринів вища, ніж триацилгліцеринів. В присутності кислотних каталізаторів (H 2SO4, сульфокислоти) процес гідролізу протікає при 100оС в надлишку води. У фазі відсутності каталізатора розщеплення відбувається при температурі 220-225оС під тиском 2-2,5 мПа.
Швидкість реакції зростає при збільшенні вологості.
Швидкість і глибина гідролізу олій характеризується кислотним числом.
Оксидоредуктази у харчових технологіях
Окиснення фенольних сполук. Поліфенолоксидаза (тирозиназа)
Фермент поліфенолоксидаза (тирозиназа, фенолаза, катехолаза, О-дифенолоксидаза) каталізує окиснення моно- ди- та поліфенолів. З дією цього ферменту пов’язано утворення темнозабарвлених сполук – маланінів - під час окиснення киснем повітря амінокислоти тирозину. Потемніння зрізів картоплі, яблук, грибів, персиків та інших рослинних тканин практично завжди повністю залежить від дії поліфенолоксидази. У харчовій промисловості основний інтерес до цього ферменту зосереджений на запобіганні цього потемніння, особливо під час сушіння плодів та овочів за допомогою:
§ бланшування - теплова інактивація ферменту,
§ додавання інгібіторів (гідросульфіту натрію, сірчистого ангідриду, хлориду натрію,
§ зв’язування субстрату метилуванням.
Небажаним є також потемніння макаронних виробів під час сушіння, а також м’якушки хлібобулочних виробів з пшеничного борошна вищого та першого сортів. Інгібіторами тирозинази в тісті є кухонна сіль, аскорбінова кислота і поліпшувачі окисної дії, наприклад, йодат калію. Активність цього ферменту знижується у разі збільшення кислотності середовища, тому доцільним є використання молочної сироватки.
Позитивний вплив дії поліфенолоксидази відмічається лише у виробництві чаю - під час ферментації відбувається окиснення дубильних речовин чаю з утворенням темнозабарвлених і водночас ароматичних сполук.
4. Ферментні препарати, їх характеристика
Ферменти містяться в рослинній та тваринній сировині та вносяться у напівфабрикати з цією сировиною. Крім того, ферменти містяться у мікроорганізмах, а також вносяться у вигляді ферментних препаратів (ФП).
Ферменти викликають перетворення під час зберігання сировини та під час перебігу технологічних процесів. Ферменти мікроорганізмів мають позитивне значення в харчових технологіях, оскільки приймають участь в різноманітних процесах бродіння, але й можуть викликати псування харчових продуктів (гниття, пліснявіння або небажане бродіння).
Мікроорганізми також використовуються для отримання ферментних препаратів. Суть технології ферментних препаратів полягає в отриманні біомаси мікроорганізмів, яка використовується для виділення даного ферменту. Для цього використовують плісняві гриби, бактерії, дріжджі. Так, a- амілазу отримують з плісневих грибів (Aspergillus niger, Aspergillus orysae та інші), з бактерій (Bacillus subtilis), глюкоамілазу та пектолітичні ферменти - з грибів Aspergillus awamori, протеїнази – з бактерій і грибів, що відносяться до родів Bacillus, Aspergillus, Penicillium та ін. Виділення ферментів полягає у екстрагуванні, осадженні органічними розчинниками, фільтруванні, сушінні. Більшість ферментних препаратів є комплексними і проявляють комплексну активність, проте в них один фермент може переважати.
Назва ферментного препарату включає назву основного ферменту та назву продуцента. Так, амілолітичні ферментні препарати, які отримують із культур A.orysae та B.subtilis називаються амілоризини (грибний) та амілосубтілін (бактеріальний). Протеолітичні ферментні препарати з культури B.subtilis називають протосубтіліном. В назву ферментного препарату включають також спосіб культивування мікроорганізмів – глибинний чи поверхневий; це позначається буквою Г або П. Наприклад, амілоризин Г10х, амілосубтілін П10х 2х, 3х, 10х, 15х, 20х – відображає ступінь очищення ФП. 2х, 3х – це ступінь очищення для технічних ферментів, 10х – 20х – для харчових ФП, яка регулюється за рахунок наповнювача. Як наповнювач використовують кухонну сіль, крохмаль, глюкозу, а для технічних цілей – перліт чи ін.. Активність ФП виражається в одиницях активності на 1г ФП. За одиницю активності прийнята така кількість ФП, яка розщеплює 1г субстрату при певних умовах. Молекулярна активність ФП дорівнює числу молекул субстрату, які перетворюються 1 молем ферменту за одиницю часу. Розрізняють також стандартні одиниці активності ферменту – це така кількість ферменту, що каталізує перетворення 1 мікромоля даного субстрату за 1 хвилину при заданих умовах.
До останнього часу у харчових технологіях використовували лише ферментні препарати вільних ферментів. Недоліки їх є невеликий термін використання – один виробничий цикл. Проте досягнення ензимології дозволили створити теоретичну базу для виробництва ферментів пролонгованої дії – іммобілізованих ферментів або фіксованих чи зв¢язаних ферментних препаратів. Суть технології іммобілізації ферментів полягає в приєднанні їх до інертної матриці. Як правило, це нерозчинний полімерний носій, наприклад, целюлоза, поліакриламід і т.п. Фермент може бути ковалентно зв¢язаний з матрицею, адсорбований на ній або фізично включений в неї.
Розрізняють такі способи іммобілізації ферменту:
1. Ковалентне зв¢язування;
2. Електростатичне зв¢язування;
3. Співполімеризація;
4. Включення в полімер;
5. Інкапсулювання – це включення ферменту в капсулу, органічну чи неорганічну, яка являє собою напівпроникну мембрану.
Іммобілізовані ферментні препарати поки що не набули широкого використання в промисловості і застосовуються для розділення D– та L–амінокислот; для отримання сиропів з високим вмістом фруктози, у виробництві сирів та стабілізаторів молока.
5. Застосування ферментних препаратів у
харчових технологіях
Застосування ферментних препаратів у харчових технологіях дає змогу інтенсифікувати технологічні процеси, поліпшувати якість продукції, економити цінну харчову сировину.
Ферментні препарати підбираються у відповідності до мети їх використання, за типом реакції, що каталізується, з урахуванням умов, в яких вони застосовуються, а саме : рН, температури середовища, присутності активаторів та інгібіторів. Крім цього, важливим є оцінка безпечності ферментних препаратів, ступінь очистки, наповнювачі, вартість.
Використання ферментних препаратів у хлібопеченні. Найбільш важливе значення у хлібопекарському виробництві при приготуванні хлібопекарського тіста мають амілолітичні та протеолітичні ферменти. Ферментативний гідроліз вуглеводів і білків забезпечує досягнення реологічних характеристик тіста, накопичення зароджуваних цукрів. Цей процес протікає під дією власних амілолітичних та протеолітичних ферментів борошна, або ферментних препаратів. Ефективність використання ферментних препаратів залежить від якості борошна. Ферментні препарати також використовуються для оцукрення заварок під час приготування рідких дріжджів, активованих дріжджів, заварних сортів хліба.
Як ферментні препарати використовують солод, ферментні препарати амілоризин П10х та амілосубтілін Г10х. Крім амілолітичної активності ці ферментні препарати мають певну протеолітичну активність. Наприклад, амілоризин має АА не< 2000 од./г, ОА не< 150 од./г, протеолітична здатність не> 70 од./г. Протосубтілін – ПЗ не< 70 од./г, АЗ не< 150 од./г. Амілосубтілін має вищу амілолітичну активність (АА не < 3000 од./г), а ПЗ не>2 од./г, але для цього ферментного препарату характерним є більш висока термостабільність a- амілази та обсемінення спорами B.subtilis та B.mesentericus, що може викликати картопляну хворобу хліба.
Використання ферментних препаратів у виробництві крохмалю та крохмалепродуктів.Крохмалево-патокова промисловість випускає широкий асортимент продукції: сухий крохмаль, модифіковані крохмалі (окислені, набухаючі, заміщені), декстрини, різні види крохмальної патоки, глюкозу, глюкозо-фруктозні сиропи. Більшість цих продуктів є продуктами гідролізу крохмалю. Застосовують кислотний, кислотно-ферментативний та ферментативний гідроліз.
Кислотний спосіб дешевший і швидкий, але гідролізати мають невисоку якість, оскільки містять продукти деградації білків, вуглеводів.
При кислотно-ферментативному способі розрідження крохмалю здійснюють за допомогою НCl при рН 1,5 – 2,5 , температурі 146 ° С протягом 5 хв. Потім нейтралізують розчин СаСО3 до рН 6,0 – 6,5 та охолоджують до температури 85° С . Після цього гідроліз проводять з допомогою ФП Амілосубтілін Г10х протягом 30 хв. Осахарювання здійснюють ФП Глюковамарином Г20х , рНопт.= 4,0 –5,5; Tопт = 56 –58 ° С.
При ферментативному способі розрідження крохмалю здійснюють з допомогою ФП Амілосубтілін Г10х при Т = 85 – 90 ° С, рН = 6,3 – 6,5 протягом 1 год.
У разі виробництва глюкозо-фруктозних сиропів використовують ФП глю-коізомеразу, яка каталізує реакцію ізомеризації глюкози до фруктози при рН опт = 7,0 – 8,5, Т опт. = 60 ° С протягом 24 год до утворення 42 % фруктози і 52 % глюкози.
Кондитерське виробництво.Під час приготування кондитерського тіста як правило процес бродіння відсутній, тому використання амілаз не є необхідним. Але для приготування тіста для печива, пряників, необхідно використовувати слабке борошно зі слабкою клейковиною. Для цього доцільно використовувати бактеріальні протеолітичні ферментні препарати. Наприклад, протосубтілін Г10х, який містить супутні амілази. Такі комплексні ферментні препарати не тільки розріджують тісто, але й завдяки накопиченню декстринів сприяють збереженню свіжості виробів.
Під час виготовлення помадних цукерок використовують препарат інвертазу для отримання м’якої консистенції при високих концентраціях цукру. Під час приготування деяких цукеркових мас, які містять молочні інгредієнти, для підсилення смаку, аромату. Використовують фермент ліпазу. Вільні жирні кислоти, які утворюються при цьому, підсилюють аромат виробів.
Застосування ферментних препаратів у технологіях соків, вин, пива, спирту.Використання ФП здійснюється з метою підвищення виходу соків, освітлення і стабілізації вин, соків попередження окислення в соках.
Для підвищення виходу соку, його освітлення застосовують пектолітичні препарати, які гідролізують пектинові речовини. Проте для повногшо освітлення вин необхідний гідроліз і інших колоїдних сполук, тому пектолітичні препарати є комплексними і містять ферменти, що гідролізують білок, целюлозу, геміцелюлозу та інші компоненти. Деякі плодово-ягідні соки і вина важко освітлюються і часто мутніють, тому що містять багато білкових сполук. Білкового помутніння можна уникнути шляхом термічної обробки і обробки адсорбентами. Але в цьому випадку видаляються і деякі інші речовини, які зумовлюють смак і аромат. Тому доцільним є використання протеолітичних ферментних препаратів.
Питання для самоперевірки
1. На які класи поділяються ферменти?
2. Які особливості мають ферменти як каталізатори?
3. Як впливають технологічні фактори на кінетику ферментативних реакцій?
4. Які гідролітичні ферменти Ви знаєте? Наведіть приклади.
5. Дайте характеристику ферментативних трансформацій крохмалю під впливом a- і β-амілаз.
6. Під впливом яких ферментів змінюються білки у харчових технологіях? Наведіть приклади.
7. Як у харчових продуктах діє фермент ліпаза? Яке значення для харчових технологій мають ці перетворення?
8. Охарактеризуйте роль ферменту β-фруктофуранозидази у харчових технологіях.
9. Під впливом яких ферментів здійснюється гідроліз некрохмальних полісахаридів? Які продукти утворюються в результаті цих процесів?
10. Значення оксидоредуктаз у харчових технологіях?
11. Охарактеризуйте роль ферменту ліпоксигенази у процесі зберігання харчових продуктів.
12. Що таке меланіни? За участю яких речовин вони утворюються у харчових продуктах? Яке значення має цей процес у харчових технологіях?
13. В чому полягає суть технології виготовлення ферментних препаратів?
14. Які продуценти використовуються в технологіях виготовлення ферментних препаратів?
15. Що таке іммобілізовані ферменти?
16. З якою метою використовуються ферментні препарати у харчових технологіях?
17. Які ферментні препарати і для чого використовують у хлібопекарському виробництві?
18. Які ферментні препарати застосовуються для розрідження та гідролізу крохмалю при виробництві патоки?
19. Наведіть приклади використання ферментних препаратів у кондитерському виробництві.
20. Які ферментні препарати слід використовувати для підвищення виходу соків, освітлення та стабілізації вин?
Рекомендована література
| <== попередня сторінка | | | наступна сторінка ==> |
| Лактоза молочна кислота | | | Методи визначення вологи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |