
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Принцип еквівалентності в титриметричному аналiзi
Титриметричний аналiз заснований на принципi еквівалентності, у вiдповiдностi з яким речовини реагують мiж собою в еквівалентних кількостях.
Наприклад, визначувана речовина А реагує з розчином титранту В за стехiометричним рiвнянням aA + bB ® Продукти реакцiї, (V)
то еквiвалентними масами цих речовин будуть aM(A) та bM(B), де M(A) та M(B) – молярнi маси речовин А i В, відповідно a i b – стехiометричнi коефiцiєнти.
Рiвняння (I) можна записати у вигляді: A + (b/a)B ® Продукти реакцiї, (VI)
Це означає, що одна частинка речовини А еквiвалентна b/a частинкам речовини В. Вiдношення b/a = fекв(В) називають фактором еквiвалентностi речовини В. Фактор еквiвалентностi є безрозмiрною величиною, рiвною або меншою від одиницi. Величину М(fекв(B)В) називають еквівалентом або еквівалентною масою речовини В.
Еквівалентом називається деяка реальна або умовна частинка, яка може приєднувати, звільняти або бути яким-небудь іншим чином еквівалентна одному йону водню в кислотно-основних реакціях або одному електрону в окисно-відновних реакціях.
При використаннi термiну “еквiвалент” або “фактор еквiвалентностi” завжди потрiбно вказувати, до якої конкретної реакцiї вiн вiдноситься. Наприклад, для реакцiї
2NaOH + H2SO4 = Na2SO4 + 2H2O
fекв(NaOH) = 1 та fекв(H2SO4) = 1/2.
Важливою величиною для розрахункiв у титриметричному аналiзi є молярна маса еквівалента речовини M(1/2H2SO4).
Вiдношення кiлькостi речовини, вираженої в еквiвалентах, до об'єму розчину називають молярною концентрацією еквівалента
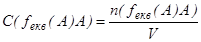 . (4.1)
. (4.1)
Розчин, що мiстить 1 моль еквiвалентiв речовини А в 1 л, називають нормальним розчином i позначають буквою "н".
Для окисно-вiдновних реакцiй молярна маса еквiвалента речовини визначається масою частини моль, що еквiвалентна одному електрону в данiй реакцiї
5Na2C2O4 + KMnO4 + 8H2SO4 « 2MnSO4 + 10CO2 + 5Na2SO4 + K2SO4 + 8H2O.
З пiвреакцiй:
C2O42– – 2e– ® 2CO2;
MnO4– + 5e– + 8H+ ® Mn2+ + 4H2O;
видно, що при окисненнi молекула Na2C2O4 вiддає 2 електрони, тому f(Na2C2O4) = 1/2 i, при вiдновленнi KMnO4 приєднується 5 електронiв, таким чином, fекв(KMnO4) = 1/5.
Молярну концентрацiю розчину, приготованого у мiрнiй колбi з точної наважки речовини А, розраховують за формулою:
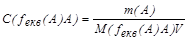 , (4.2)
, (4.2)
де m(A) - наважка речовини А (г); M(fекв(A)A) – молярна маса еквiвалента речовини А (г/моль); V – об’єм мiрної колби, л.
Дещо перетворену формулу (4.2) можна використати для обчислення маси речовини А, потрiбної для приготування певного об'єму V(A) розчину заданої концентрацiї C(fекв(A)A):
m(A) = M(fекв(A)A) C(fекв(A)A) V(A). (4.3)
Титр - один iз способiв вираження концентрацiї - число грамів розчиненої речовини в 1 мл розчину. Зв'язок мiж концентрацiєю речовини в моль/л i титром виражає формула:
TA = C(A) M(A)/1000, (г/мл). (4.4)
Деколи вживають поняття титр стандартного розчину A за речовиною B:
TA/B = C(A) M(B)/1000, (г В/мл р-ну А). (4.5)
Переглядів: 269