
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Методи вибору індикаторів
Точнiсть кiлькiсного титриметричного аналiзу залежить вiд правильного вибору iндикатора. Цей вибiр можна зробити такими способами:
- розрахунком рН в точцi еквiвалентностi;
- побудовою кривих титрування та їх аналiзу;
- розрахунком величини iндикаторних похибок титрування.
1. Вибір індикатора за розрахунком pH в точці еквівалентності.
Найпростішим способом вибору iндикатора є розрахунок значення рН у точцi еквiвалентностi та пiдбiр такого iндикатора, показник титрування якого рТ наближено спiвпадає з рН у точцi еквiвалентностi (т.е.):
рТ @ рНт.е.
2. Вибір індикатора за кривою титрування.
Цей спосiб є складнішим, однак він зручний та дозволяє робити вибiр з декiлькох iндикаторiв.
Крива титрування - це графічне зображення залежності зміни рН розчину, який титрують, вiд об’єму доданого титранту.
Для побудови кривої титрування треба розрахувати величини рН розчину до точки еквiвалентностi, в точці еквівалентності та пiсля неї.
Для повноти картини можна розрахувати рН розчину до початку додавання титранту.
Титрування сильної кислоти сильною основою (чи навпаки). Розрахуємо криву титрування 0,1 М розчину HCl 0,1 M розчином NaOH. Для спрощення розрахункiв допустимо, що об’єм розчину HCl складає 100 см3 та що цей об’єм в процесi титрування не змінюється. Титрування описується реакцією
HCl + NaOH↔NaCl+ Н2О.
Спочатку обчислимо рН вихiдного розчину, тобто 0,1 М розчину HCl. Це розчин сильної кислоти, яка повнiстю дисоцiює, а тому [H+]=C(HCl)=0,1 M i, вiдповiдно, рН=1.
Під час додавання 10,0 мл розчину лугу в реакцiю вступить 10 % кислоти, а в розчинi залишиться 90 % невiдтитрованої HCl. Вiдповiдно її концентрацiя, концентрацiя йонiв H+ та рН розчину становитимуть: C(HCl)=[H+]=(0,1∙90)/100=0,09 M, pH=-lg(0,09)=1,05.
Додавання все бiльшої кiлькостi лугу приведе до зменшення концентрацiї HCl та [H+] i росту рН розчину.
В точцi еквiвалентностi, коли вся кислота повнiстю прореагує з лугом в розчині буде знаходитись NaCl - сіль, утворена сильною кислотою і сильною основою, яка не гідролізує, рН розчину буде визначатися дисоціацією води i становитиме pH=7,0.
Після точки еквiвалентностi рН розчину буде визначатися надлишком доданого лугу, який також повнiстю дисоцiює. Коли додано 100,1 мл розчину лугу, то його надлишок складе 0,1 мл, концентрацiя в розчинi C(NaOH)=[OН–]=(0,1∙0,1)/100=0,0001 M, а [H+]=(1∙10–14)/(1∙10–4)=1∙10–10 i рН=10.
Ще більший надлишок лугу приведе до зростання концентрацiї йонів ОН– i, вiдповiдно, росту рН. Результати цих обрахункiв приведені в таблиці 5.1.
Таблиця 5.1
Розрахунок [H+] та рН розчину в процесі титрування
0,1 М розчину HCl 0,1 M розчином NaOH
| V(NaOH), см3 | [H+], [OH–], моль/дм3 | рН |
| 0,1 | 1,0 | |
| (0,1∙90)/100 = 0,09 | 1,1 | |
| (0,1∙50)/100 = 0,05 | 1,3 | |
| (0,1∙10)/100 = 0,01 | 2,0 | |
| (0,1∙1)/100 = 0,001 | 3,0 | |
| 99,9 | (0,1∙0,1)/100 = 0,0001 | 4,0 |
| 100,0 (т.е.) | [H+] = [OH–] = 1∙10-7 | 7,0 |
| 100,1 | [OH– ]=(0,1∙0,1)/100=0,0001, [H+]=1∙10-10 | 10,0 |
| [OH–]=(0,1∙1)/100=0,001, [H+]=10-1 | 11,0 | |
| [OH–]=(0,1∙10)/100=0,01, [H+]=10-12 | 12,0 | |
| [OH–]=(0,1∙20)/100=0,02, [H+]=10-13 | 12,3 |
За цими даними будуємо криву титрування в координатах рН-V(NaOH) (рис. 5.1).
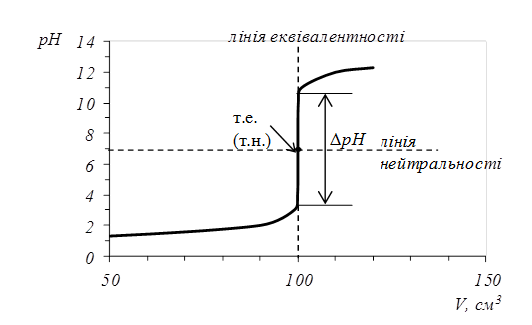
Рис. 5.1. Крива титрування 0,1 М розчину НС10,1 М розчином NaOH.
Точку перетину кривої титрування з лiнiєю еквiвалентності називають точкою еквівалентності (т.е.), а перетин кривої титрування з лiнiєю нейтральностi називають точкою нейтральності (т.н.). Під час титрування сильної кислоти лугом та навпаки ці точки спiвпадають. Різку зміну pH біля точки еквівалентності називають стрибком титрування (ΔрН). Він спостерігається вже тоді, коли розчин на 0,1 % недотитрований чи на 0,1 % перетитрований порівняно з еквівалентною кількістю. Це найбiльш суттєва частина кривої титрування, яка використовується для вибору iндикатора.
Крива титрування сильної основи кислотою може бути розрахована аналогiчно i є симетричним вiдображенням кривої титрування сильної кислоти лугом вiдносно лiнiї еквiвалентностi.
Для вибору індикатора за кривою титрування користуються правилом: показник титрування індикатора повинен співпадати із стрибком титрування:
рТ=рН100,1 - рН99,9.
Титрування слабкої кислоти сильною основою (чи навпаки). У цьому випадку вже не можна концентрацію водневих йонів обчислювати як загальну концентрацію кислоти, оскільки основна її частина знаходиться у розчині у вигляді нейонізованих молекул і тільки дуже незначна її кількість дисоціює з утворенням H+. Тому для обчислення рН використовують рівняння константи дисоціації відповідної слабкої кислоти. Для розрахунку кривої титрування необхідно розрахувати рН розчину для чотирьох випадків: 1) до початку титрування, коли в розчині знаходиться тільки слабка кислота; 2) коли розчин недотитрований, тобто, коли у ньому знаходиться слабка кислота та продукт реакції - її сіль (буферний розчин); 3) в точці еквівалентності, коли у розчині знаходиться тільки сіль слабкої кислоти та сильної основи; 4) коли розчин перетитрований і у ньому присутній надлишок сильної основи.
Побудову такої кривої розглянемо на прикладі титрування ацетатної кислоти натрій гідроксидом:
СН3СООН + NaOH ↔СН3СООNa + Н2О.
Як вихідні значення для розрахунків приймемо, що титруємо 100 см3 0,1 М розчину СН3СООН 0,1 М розчином NaOH, КСН3СООН=1,74∙10-5 (рКСН3СООН=-lg(1,74∙10-5)=4,76), а об’єм розчину не змінюється.
В початковий момент рН розчину розраховується за формулою (3.12) для слабкої кислоти: рН= ½ 4,76 - ½ lg(0,1)=2,88.
Коли відтитровано 10 % кислоти, тобто використано 10 см3 титранту розрахунок ведуть за формулою (3.15) для кислої буферної суміші, оскільки в розчині знаходиться невідтитрована кислота (90 %) і її сіль (10 %) як продукт реакції:
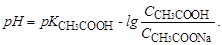 (5.2)
(5.2)
Концентрації кислоти та солі знаходимо згідно закону еквівалентів ССН3СООН∙VCH3COOH=ССН3СООNa∙VCH3COONa. Оскільки ССН3СООН=ССН3СООNa, то рівняння (5.2) прийме вигляд:
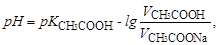 а рН=4,76-lg(90/10)=3,81.
а рН=4,76-lg(90/10)=3,81.
До досягнення точки еквівалентності рН розчину буде визначатися наявністю в ньому буферної суміші, тому і далі розраховуватиметься за формулою (5.2) (таблиця 5.2).
В точці еквівалентності, коли у розчині присутні тільки продукти реакції, його рН обчислюємо за формулою (3.19) для солі, що гідролізує за аніоном.
Коли розчин є перетированим і у ньому є надлишок сильної основи, то саме він має вирішальний вплив на концентрацію водневих іонів, тому рН такого розчину розраховують за формулою для сильної основи.
Результати розрахунків приведені в таблиці 5.2 і за їх значеннями побудовано криву титрування (рис. 5.2.)
Таблиця 5.2
Розрахунок [H+] та рН розчину в процесі титрування
0,1 М розчину СН3СООН 0,1 M розчином NaOH
| V(NaOH), см3 | Надлишок, см3 | 
| Обчислення | рН | |
| кислоти | лугу | ||||
| - | - | рН= ½ 4,76 - ½lg(0,1) | 2,88 | ||
| - | 90/10 | рН=4,76-lg(90/10) | 3,81 | ||
| - | 50/50 | рН=4,76-lg(50/50) | 4,76 | ||
| - | 10/90 | рН=4,76-lg(10/90) | 5,71 | ||
| - | 1/99 | рН=4,76-lg(1/99) | 6,76 | ||
| 99,9 | 0,1 | - | 0,1/99,9 | рН=4,76-lg(0,1/99,9) | 7,76 |
| 100 (т.е.) | - | - | - | рН=7+4,76/2+ lg(0,1/2) | 8,88 |
| 100,1 | - | 0,1 | - | [OH– ]=(0,1∙0,1)/100=0,0001, [H+]=1∙10-10 | 10,0 |
| - | - | [OH–]=(0,1∙1)/100=0,001, [H+]=10-11 | 11,0 | ||
| - | - | [OH–]=(0,1∙10)/100=0,01, [H+]=10-12 | 12,0 |
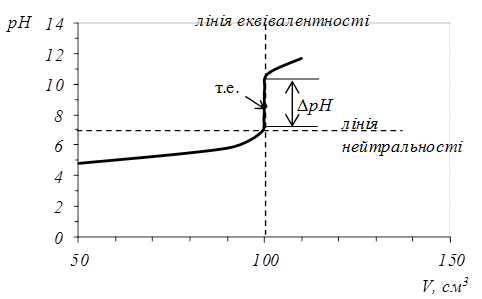
Рис. 5.2. Крива титрування 0,1 М розчину СН3СООН0,1 М розчином NaOH.
Порівнюючи ці дві криві бачимо, що: а) точка еквівалентності не збігається з точкою нейтральності, а лежить в ділянці рН>7;б) стрибок титрування є меншим, ніж у випадку титрування сильної кислоти. Тобто можна зробити висновок, що чим слабшою є кислота (більшим є значення рК), тим меншим є стрибок титрування. За значень рК>9 стрибок зникає зовсім, тому слабкі кислоти з подібними значеннями константи дисоціації титрувати неможливо.
У випадку титрування слабкої кислоти сильною основою зменшується кількість можливих індикаторів, ніж під час титрування сильної кислоти оскільки значення стрибка титрування ΔрН є меншим.
Крива титрування слабкої основи сильною кислотою розраховується з подібних міркувань.
3. Вибір індикатора за індикаторною похибкою титрування
Придатнiсть того чи iншого iндикатора для даного титрування можна кiлькiсно охарактеризувати індикаторною похибкою титрування, яка виникає через незбігання рТ індикатора та рНт.е..Тобто фактично розчин або незначно недотитровують або ледь перетитровують, в результаті чого у ньому міститься невелика кількість кислоти або основи.
1. Воднева похибка (dН+) спостерігається коли у розчині є надлишок йонів Н+, тобто рТ < рНт.е.:
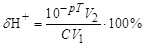 , (5.3)
, (5.3)
де V1 - початковий об’єм розчину (мл); V2 - об’єм розчину в кінці титрування (мл); С - концентрація сильної кислоти (моль/дм3).
2. Гідроксильна похибка (dОН–) спостерігається у разі надлишку в розчині йонів ОН–, коли рТ > рНт.е.:
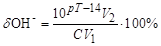 . (5.4)
. (5.4)
3. Кислотна похибка (dНАn) спостерігається, коли в розчині в надлишку є слабка кислота:
dНАn=10рК–рТ∙100%. (5.5)
4. Основна похибка (dKtOH) спостерігається під час надлишку в розчині слабкої основи.
dKtOH = 10рК+рТ–14∙100%. (5.6)
Якщо розчин недотитрований, то похибка має знак «–», якщо перетитрований - знак «+».
Якщо розрахована величина індикаторної похибки задовільняє вимоги до точності аналізу (0,1 %), то індикатор придатний для даного титрування.
Переглядів: 2696