
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Загальна характеристика методу
Титриметричнi методи аналiзу, які базуються на реакцiях утворення комплексних сполук з неорганічними лігандами, називають комплексометричними, а з органічними (комплексонами) - комплексонометричними.
Комплексними сполуками вважають речовини, утворені двома або більшим числом частинок, здатних до самостiйного iснування в розчинi. Однiєю з частинок переважно є додатнiй йон металу, що називається центральним йоном, або комплексоутворювачем. Безпосередньо з центральним атомом зв'язанi лiганди (йони з вiд’ємним зарядом або нейтральнi молекули), якi складають внутрішню координаційну сферу сполуки.
Крiм внутрiшньої сфери, iснує також i зовнішня координаційна сфера, яку складають зовнiшнi йони з додатним або вiд’ємним зарядом, наприклад, K4[Fe(CN)6].
Важливою характеристикою координацiйної сполуки є координаційне число, яке показує, скiльки атомiв або атомних груп зв'язано з центральним атомом (найчастiше 6 та 4).
Хімiчнi реакцiї, що використовуються в комплексометрiї, повиннi відповідати вимогам:
- повинна протiкати тільки одна реакцiя, яка вiдповiдає певнiй стехiометрiї;
- реакцiя повинна протiкати досить швидко;
- комплексна сполука, що утворюється, повинна мати велику стiйкiсть, тобто реакцiя повинна мати достатньо велику константу рiвноваги.
Комплексонами називають похідні полiамiнополiкарбонових кислот, які можуть утворювати з йонами металів стійкі, слабодисоційовані, розчинні у воді внутрішньокомплексні (хелатні) сполуки.
Найвідомішими комплексонами є етилендиамiнтетраацетатна кислота H4Y, (ЕДТО, комплексон II):(HOC(О)CH2)2NCH2CH2N(CH2C(O)OH)2 та натрiй етилендиамінтетрацетат Na2H2Y∙2H2O(ЕДТА, трилон Б, комплексон III).
ЕДТО (H4Y) - безбарвна, погано розчинна в водi та етанолi речовина. Сiль ЕДТА (Na2H2Y) - бiла, дрiбнокристалiчна речовина, добре розчинна у водi, розчинах лугiв та сильних кислот. Хімiко-аналiтичнi властивостi солi ЕДТА iдентичнi до властивостей ЕДТО, тому всi питання комплексонометрiї розглядатимуться на прикладi використання цього реактиву.
В молекулах комплексонiв є групи, якi мають основнi та кислотнi властивостi. До груп з основними властивостями належать: третинна- ºN, первинна- –NH2, iмiно- =NH, оксимна- =N–OH, карбонільна- =C=O та iншi групи, якi можуть утворювати з йонами металiв донорно-акцепторнi зв’язки за рахунок неподiлених електронних пар атомiв нітрогену чи оксигену. Кислотнi групи мiстять йони H+, якi можуть замiщуватися на йони металу за рахунок головної валентностi. Це карбоксильна група –C(O)OH, а також сульфоксильна –SO3H, гiдроксильна –OH та iншi групи.
Під час утворення хелатної сполуки йон металу утворює зв’язки, одночасно замiщуючи йон водню та координуючись за рахунок неподiлених електронних пар донорних атомiв таким чином, щоб найкраще задовольнити координацiйнi та геометричнi вимоги йону металу.
Реакцiї взаємодiї рiзних катiонiв з ЕДТА в розчинi описуються рiвняннями:
Ca2+ + H2Y2– « CaY2– + 2 H+,
Bi3+ + H2Y2– « BiY– + 2 H+,
Zr4+ + H2Y2– « ZrY + 2 H+.
Як бачимо, не залежно вiд заряду катiона в реакцiї комплексоутворення приймає участь один аніон ЕДТА та утворюється два йони водню, тобто взаємодія відбувається у співвідношенні Ме:L = 1:1, тому молярні маси еквіваленту титранту та визначуваного катіона завжди дорівнюють їх молярним масам.
Комплексонати металiв мiстять рiзне число хелатних циклiв. Так йони Zn2+, Cd2+, Ca2+ та iнших металiв з координацiйним числом 4 мають по три п’ятичленні цикли:
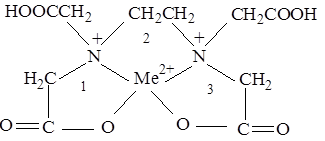
Для дво-, три- та чотиривалентних металiв з координацiйним числом 6 (Al3+, Co2+, Fe3+ та ін.) число хелатних циклiв становить 5. Бiльша кількість хелатних циклiв в комплексонатах та пов’язаний з цим хелатний ефект є однiєю з головних причин високої стiйкостi цих сполук.
Iснує просте правило, яке дозволяє вибирати орiєнтовне значення рН розчину, необхiдне для перебігу реакцiї комплексоутворення йона металу з комплексонами: чим легше йон металу піддається гідролізу, тим в більш кислому середовищі проходить його взаємодія з ЕДТА.
Наприклад, йон Fe3+, що гiдролiзує за рН = 2, взаємодiє з ЕДТА в кислому середовищi; йон Ni2+, що слабо гiдролiзує вже в нейтральному середовищi, реагує з ЕДТА в нейтральному середовищi, а йон Ca2+, що практично не пiддається гiдролiзу, реагує з ЕДТА в лужному середовищi.
Переглядів: 306