
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції окиснення
На повітрі бензен горить сильно кіптявим полум'ям, оскільки вміст Карбону у ньому значний. Суміш пари бензену з повітрям вибухова. Завдяки ароматичному характеру бензен стійкий до дії окисників: не окиснюється розчином перманганату калію і нітратною кислотою. У присутності каталізатораванадій(V) оксиду реагує із молекулярним киснем, внаслідок чого утворюється малеїновий ангідрид:
Також бензен окиснюється озоном, ця реакція історично використовувалась для встановлення його будови.
Бензен є важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензену, який за реакцією М. М. Зінінавідновлюють в анілін.
У суттєво менших кількостях бензол використовується для синтезу деяких інших сполук. Зрідка і в крайніх випадках, через високої токсичності, бензол використовується в якості розчинника. Крім того, бензол входить до складу бензину. Зважаючи на високу токсичності його зміст новими стандартами обмежена введенням до 5 %.
27) Складемо електронні формули атомів деяких хімічних елементів другого періоду. Після заповнення першого енергетичного рівня електрони заповнюють другий рівень, на якому може розміщуватись не більше, ніж вісім електронів. На другому рівні спочатку електрони заповнюють 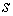 -підрівень, а потім
-підрівень, а потім 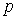 -підрівень.
-підрівень.
На другому енергетичному рівні атома не може знаходитися більше, ніж вісім електронів, тому другий енергетичний рівень атома Неону є завершеним.
28) Під час вивчення складу глюкози з'ясували, що її найпростіша формула СН2О, а молярна маса 180 г/моль. Звідси можна дійти невтішного висновку, що молекулярна формула глюкози С6Н12О6.
Для встановлення структурної формули молекули глюкози треба зазначити її хімічні властивості. Експериментально довели, що перший міль глюкози реагує з п'ятьма молями оцтової кислоти із заснуванням складного ефіру. Це означає, що у молекулі глюкози є п'ять гідроксильних груп. Оскільки глюкоза з аміачним розчином оксиду срібла дає реакцію "срібряного дзеркала", то її молекулі мала б бути альдегідна група.
Опитним шляхом також довели, що глюкоза має неразветвлённую вуглецеву ланцюг.
З цих даних будова молекули глюкози можна сформулювати так:
Як очевидно з структурної формули, глюкоза є одночасно багато-
атомним спиртом і альдегідом, тобто. альдегидоспиртом.
Т.к. в молекулі глюкози С6Н12О6 шість атомів вуглецю, вона представник гексоз.
Фізичні властивості:
Глюкоза- безкольорове кристалічний в-во із солодким смаком, добре розчиняється у питній воді.
Порівняно з буряковою цукром вона менш солодка.
Хімічні властивості:
Глюкоза має хімічними властивостями, притаманними спиртів і альдегідів.
Застосування:
Глюкоза є цінним поживним продуктом. У організмі її піддають складним біохімічним перетворенням, у яких звільняється енергія, що нагромадилася у процесі фотосинтезу.
Оскільки глюкоза легко усваевается організмом, її використав медицині як зміцнювального лікувального засобу.
Широко застосовують глюкозу в кондитепском справі.
29) Періодична система являє собою природну класифікацію хімічних елементів по електронних структурах атомів. У міру зростання заряду ядра атомів хімічних елементів періодично змінюється будова їх електронних оболонок. Ця періодична зміна і обумовлює періодичну зміну властивостей хімічних елементів та їх сполук. В ряду хімічних спостерігається не тільки повторення електронної конфігурації, але і ускладнення її. Тому в елементів з подібною будовою зовнішнього електронного шару виявляється як подібність, так і відмінність у властивостях.
На підставі положення в Періодичній системі та електронній конфігурації елемента можна передбачити деякі його властивості та охарактеризувати відносно інших хімічних елементів.
План характеристики елемента за його положенням у Періодичній системі та будовою атома.
І. Назва елемента, його символ, відносна атомна маса.
ІІ. Положення у Періодичній системі:
 порядковий номер;
порядковий номер;
 номер періоду;
номер періоду;
 номер групи, підгрупа.
номер групи, підгрупа.
30) Жири — велика група органічних сполук, які, з фізичного погляду, мають меншу від одиниці питому вагу і, як правило, розчинні в неполярних органічних розчинниках, як правило не розчиняються у воді, і під звичайним тиском їх не можна перегнати, не розклавши. Хімічно, жири є тригліцеридами, сполукою складних ефірів триатомного спирту (гліцерину) і будь-якою з кількох жирних кислот. Містяться у тваринних і рослинних організмах. Кожна молекула рослинного аботваринного жиру являє собою змішаний естер гліцерину. Такий жир може бути моно-, ді- та тригліцеридом різнихорганічних кислот.
Найбільше характерним для естерів карбонових кислот є гідролітичне (під дією води) розщеплення етерового зв'язку, у нейтральному середовищі воно протікає повільно і помітно прискорюється в присутності основ або кислот, які каталізують цей процес. Гідроліз у присутності лугів називають омиленням. Процес омилення жирів проводять у промисловому масштабі, при цьому одержують гліцерин і солі вищих карбонових кислот, що являють собою мило.
Етилформіат та етилацетат використовуються як розчинники целюлозних лаків. Естери на основі нижчих спиртів і кислот використовують у харчовій промисловості при створенні фруктових есенцій, а на основі ароматичних спиртів — у парфумерній промисловості.
Воски входять до складу косметичних кремів і лікарських мазей. Тваринні жири і олії являють собою сировину для одержання вищих карбонових кислот, миючих засобів і гліцерину.
На основі рослинних олій виготовляють оліфи, що складають основу олійних фарб.
Нітрогліцерин — відомий лікарський препарат і вибухова речовина, основа динаміту.
31) Вчення про будову атомів розкрило глибокий фізичний зміст періодичного закону. Сучасне формулювання періодичного закону Д.І. Менделєєва таке:
властивості елементів, а також форми і властивості сполук елементів перебувають у періодичній залежності від величини заряду ядер їх атомів.
Таке формулювання закону зовсім не суперечить формулюванню, яке дав Д. І. Менделєєв. Воно тільки базується на нових даних, які надають закону і системі наукової обґрунтованості і підтверджують їх правильність. Періодична система елементів Д. І. Менделєєва віддзеркалює періодичний закон, а водночас і будову атомів елементів.
Теорія будови атомів пояснює періодичну зміну властивостей елементів. Збільшення позитивних зарядів атомних ядер від 1 до 107 спричиняє періодичне повторення будови зовнішнього енергетичного рівня. А оскільки властивості елементів залежать в основному від числа електронів на зовнішньому рівні їх атомів, то вони також періодично повторюються. У цьому фізичний зміст періодичного закону.
У малих періодах зі збільшенням позитивного заряду ядер атомів збільшується число електронів на зовнішньому рівні , чим пояснюється зміна властивостей елементів: на початку періоду (крім І періоду) розташований лужний метал, далі металічні властивості поступово слабшають і посилюються властивості неметалічні. У великих періодах зі збільшенням зарядів ядер заповнення рівнів електронами відбувається складніше , чим пояснюється і складніша зміна властивостей елементів порівняно з елементами малих періодів. Так, у парних рядах великих періодів зі збільшенням заряду число електронів на зовнішньому рівні залишається стабільним і дорівнює 2 або 1. Тому, поки відбувається заповнення електронами наступного за зовнішнім (другого ззовні) рівня, властивості елементів у цих рядах змінюються надзвичайно повільно. Лише в непарних рядах, коли зі збільшенням заряду ядра збільшується число електронів на зовнішньому рівні (від 1 до 8), властивості елементів починають змінюватися так само, як у типових.
32) Мета́н — найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху.
Молекулярна формула СН4. Структурна і електронна формули:
Н
|
Н — С - Н
|
H
Перший член гомологічного ряду насичених (метанових) вуглеводнів. Метан являє собою малоактивну в хімічному відношенні речовину. При звичайних умовах він досить стійкий до дії кислот, лугів і окисників. Так, при пропусканні метану через розчин KMnO4, який є досить сильним окисником, він не окислюється і фіолетове забарвлення розчину не зникає. В реакції приєднання (сполучення) метан не вступає, оскільки в його молекулі всі чотири валентності атома вуглецю повністю насичені. Для метану, як і інших насичених вуглеводнів, типовими є реакції заміщення, при яких атоми водню заміщаються атомами інших елементів або атомними групами. Характерна для метану також реакція з хлором, яка відбувається при звичайній температурі під впливом розсіяного світла (при прямому сонячному світлі може статися вибух). При цьому атоми водню в молекулі метану послідовно заміщаються атомами хлору:
· CH4 + Cl2 = CH3Cl + HCl
· CH3Cl + Cl2 = CH2Cl2 + HCl
· CH2Cl2 + Cl2 = CHCl3 + HCl
· CHCl3 + Cl2 = CCl4 + HCl
Внаслідок реакції утворюється суміш хлоропохідних метану.
В атмосфері повітря метан горить безбарвним полум'ям з виділенням значної кількості тепла:
· CH4 + 2O2 = СО2 + 2Н2О
З повітрям метан утворює вогненебезпечну вибухову суміш. При нагріванні метану без доступа повітря до температури вище 1000 °C він розкладається на елементи — на вуглець (сажу) і водень:
· CH4 = С + 2Н2
Великі кількості метану використовуються як зручне і дешеве паливо. Неповне спалювання метану дає сажу, яка йде на виготовлення друкарської фарби і як наповнювач каучуку, а при термічному розкладі (вище 1000 °C) одержують сажу і водень, який використовують для синтеза амоніаку. Продукт повного хлорування метану — тетрахлорид вуглецю CCl4 — є добрим розчинником жирів і застосовується для екстрагування жирів з зерен олійних рослин. Метан служить також вихідною речовиною для одержання ацетилену, метилового спирту і багатьох інших хімічних продуктів.
33) Аромати́чні вуглево́дні — органічні сполуки, які належать до класу карбоциклічних сполук. У складі молекули ароматичних вуглеводнів є одна або кілька груп з 6 атомів вуглецю(Карбону), сполучених у кільце простими і подвійними зв'язками. За сучасними уявленнями, атоми Карбону в бензеновому ядрі сполучені електронами двох типів: одні електрони містяться в площині молекули, інші розміщені перпендикулярно до неї.
Бензе́н (також бензол) — перший представник гомологічного ряду ароматичних вуглеводнів, молекулярна формула C6H6. Безбарвна летка рідина з характерним запахом.
Залежно від числа бензенових ядер у молекул ароматичних сполук, арени поділяють на одноядерні, двох’ядерні, триядерні тощо. До одноядерних аренів належать бензен та його похідні, загальна формула вуглеводнів ряду бензену: СnН2n-6. Відповідно, першим членом гомологічного ряду одноядерних аренів є вуглеводень із шістьма атомами Карбону, тобто С6Н6 — бензен. Формула наступного члена гомологічного ряду відрізняється від бензолу на групу СН2 - С7Н8 (метилбензен, або толуен). До двох’ядерних аренів належать нафталін та його похідні, загальна формула вуглеводнів ряду нафталіну: СnН2n-12 (першим членом гомологічного ряду є вуглеводень із десятьма атомами Карбону С10Н8 — нафталін). Загальна формула триядерних аренів: СnН2n-18 (перший член ряду містить 14 атомів Карбону С14Н10).
Ароматичні вуглеводні відзначаються особливою здатністю до реакцій заміщення і стійкістю бензенового ядра. При заміні водню в ароматичних вуглеводнів на галоген утворюються галогенопохідні; при реакціях з концентрованою азотною або сірчаною кислотами — нітросполуки або сульфосполуки.
Ароматичні вуглеводні майже не здатні до реакцій приєднання.
· Реакція горіння (на прикладі бензолу):
2 C6H6 + 15 O2 → 12 CO2 + 6 H2O
Арени горять кіптявим полум'ям, що свідчить про великий вміст Карбону.
· Реакції заміщення.
· Галогенування (на прикладі бензолу):
C6H6 + Br2 (чиста речовина) → C6H5Br + HBr
Реакція відбувається за умови каталізатора FeCl3 і простої речовини Br2 у чистому вигляді до утворення хлорбензолу і бромідної кислоти.
На прикладі толуену:
C6H5CH3 + 3 Br2 (водний розчин) → C6H5Br3CH3 + 3 HBr
Реакція відбувається за звичайних умов при взаємодії толуену з бромною водою (розчин простої речовини брому у воді) до утворення 2,4,6-трибромтолуену (2,4,6-бром-1-метилбензен) - білого осаду (якісна реакція на толуен) і бромідної кислоти у співвідношенні 1:3
При заміщенні аренів атомом Хлору (Cl) використовується каталізатор AlCl3
· Нітрування (на прикладі бензолу):
C6H6 + HONO2 → C6H5NO2 + H2O
В результаті взаємодії бензолу і нітратної кислоти утворюється нітробензен і вода. В результаті реакції утворюється жовта рідина і запах гіркого мигдалю, що є якісною реакцією на бензен. Реакція відбувається за наявності каталізатора H2SO4 (концентрованого розчину) - сульфатної кислоти, що є дужегігроскопічною речовиною і поглинає воду, а також високої температури.
· Окиснення (на прикладі толуену):
C6H5CH3 + 3 [O] C6H5COOH + H2O
Окисником виступає KMnO4 (перманганат калію). В результаті окиснення утворюється бензойна кислота, оксид марганцю(IV) і вода. Під час реакції відбувається знебарвлення розчину перманганату калію.
· Приєднання.
· Гідрування (на прикладі бензолу):
C6H6 + 3 H2 → C6H12
При приєднанні до бензола атомів водню утворюється циклогексан. Відбувається розірвання подвійних зв'язків (у формулі Кекуле). Реакція відбувається за наявності нікелевого каталізатора і підвищеної температури
· Хлорування (на прикладі бензолу):
C6H6 + 3 Cl2 → C6H6Cl6
При приєднанні до бензола атомів хлору утворюється гексахлорциклогексан (гексахлоран). Реакція відбувається лише за наявності світла.
34) Дисахариди— вуглеводи, які при нагріванні з водою в присутності мінеральних кислот чи під дією ферментів піддаються гідролізу, розкладаються на дві молекули моносахаридів. Легко розчиняються у воді, добре кристалізуються, солодкі на смак. При окисленні дають альдонові кислоти, відновленні — спирти, при гідролізі — моносахариди. Як у вільному стані, так і в складі ін. молекул дуже поширені в тваринних і рослинних організмах. Найпоширеніші дисахариди: сахароза (цукор), лактоза, мальтоза. Дисахариди - цінні харчові й смакові речовини; деякі дисахариди застосовують у мікробіології та фармації.
Молекулярна маса 342,3 а. е. м. Брутто-формула (система Хілла): C12H22O11. Смак солодкуватий. Розчинність (грам на 100 грам): у воді 179 (0 ° C) і 487 (100 ° C), в етанолі 0,9 (20 ° C). Малорозчинний у метанолі. Не розчинна в діетиловому ефірі. Густина 1,5879 г/см3 (15 ° C). Питоме обертання для D-лінії натрію: 66,53 (вода, 35 г/100г; 20 °C). При охолодженні рідким повітрям, після висвітлення яскравим світлом кристал цукрози фосфоресціює. Не проявляє відновлювальних властивостей — не реагує з реактивом Толленса і реактивом Фелінга. Не утворює відкриту форму, тому не проявляє властивостей альдегідів і кетонів. Наявність гідроксильних груп в молекулі цукрози легко підтверджується реакцією з гідроксидами металів. Якщо розчин сахарози долити до гідроксиду міді (II), утворюється яскраво-синій розчин цукриту міді. Альдегідної групи в цукрозі немає: при нагріванні з аміачним розчином оксиду срібла (I) вона не дає «срібного дзеркала», при нагріванні з гідроксидом міді (II) не утворює червоного оксиду міді (I). З числа ізомерів цукрози, що мають молекулярну формулу С12Н22О11, можна виділити мальтозу і лактозу.
Переглядів: 3428