
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічні властивості алкінів
Хімічні властивості алкінів обумовлені наявністю в їхніх молекулах потрійного зв’язку. Типовими реакціями для ацетилену та його гомологів є реакції приєднання. Відмінність алкінів від алкенів полягає в тому, що реакції приєднання можуть протікати у дві стадії. На першій стадії йде приєднання до потрійного зв’язку утворенням подвійного зв’язку, а на другій стадії — приєднання за подвійним зв’язком. Реакції приєднання для алкінів протікають повільніше, ніж для алкенів.
1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднання брому до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану:
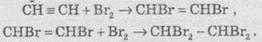
Алкіни, так само як і алкени, знебарвлюють бромну воду.
2. Гідрогалогенування. Галогеноводні приєднуються до потрійного зв’язку важче, ніж до подвійного. Для активації галогеноводню використовують АlСl3. З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду:
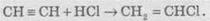
У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад:
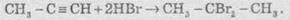
3. Гіоратація. Приєднання води до алкінів каталізується солями ртуті (II):
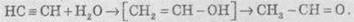
На першій стадії реакції утворюється ненасичений спирт, в якому гідроксильна група перебуває безпосередньо в атома Карбону при подвійному зв’язку. Такі спирти заведено називати вініловими, або енолами. Прикметною рисою енолів є їхня нестійкість. У момент утворення вони ізомеризуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок перенесення протона від гідроксильної групи до сусіднього атома Карбону при подвійному зв’язку. При цьому подвійний зв’язок між атомами Карбону розривається й утворюється подвійний зв’язок з атомом Карбону та атомом Оксигену. Причиною ізомеризації є більша міцність подвійного зв’язку С=О порівняно з подвійним С=С.
У результаті реакції гідратації тільки ацетилен перетворюється в альдегід; гідратація гомологів ацетилену протікає за правилом Марковникова, і утворені еноли ізомеризуються в кетони. Наприклад, пропін перетворюється в ацетон:
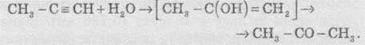
Реакцію гідратації алкінів відкрив М.Г. Кучеров (1881 р.), саме тому її й називають реакцією Кучерова.
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв’язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами:

Ацетиленіди Аргентуму и Купруму(I) легко утворюються й випадають в осад при пропусканні ацетилену через аміачний розчин аргентум оксиду або купрум(І) хлориду. Ці реакції слугують для виявлення алкінів з потрійним зв’язком у кінці ланцюга:
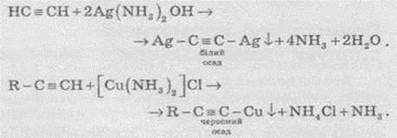
Ацетиленіди Арґентуму й Купруму як солі дуже слабких кислот легко розкладаються при дії хлороводневої кислоти з виділенням вихідного алкіну:
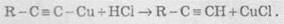
Таким чином, використовуючи реакції утворення й розкладу ацетиленідів, можна виділяти алкіни із сумішей з іншими вуглеводнями.
5. Полімеризація. У присутності каталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. Так, під дією водного розчину СuСl та NH4Cl ацетилен димеризується, утворюючи вінілацетилен:
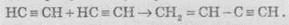
Вінілацетилен має велику реакційну здатність, приєднуючи хлороводень, він утворює хлоропрен, який використовують для добування штучного каучуку:
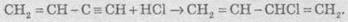
При пропусканні ацетилену над активованим вугіллям при температурі +600 °С відбувається тримеризація ацетилену з утворенням бензену:
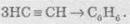
В аналогічні реакції тримеризації можуть також вступати й найближчі гомологи ацетилену, наприклад:
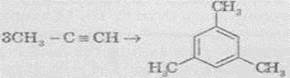
6. Реакції окиснення й відновлення. Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв’язку. При окисненні зазвичай відбувається розщеплення потрійного зв’язку, утворюються карбонові кислоти:
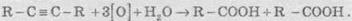
У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани:
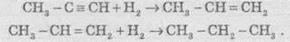
29.
Бензен, як представник ароматичних вуглеводнів, його склад, будова молекули. Фізичні властивості.
Ароматичними називаються вуглеводні, у молекулах яких міститься одне або кілька бензольних кілець.
Найпростішим представником ароматичних вуглеводнів є бензол (або бензен) C6H6. Будову молекули бензолу вперше запропонував німецький хімік Кекуле у 1865 році.
Атоми Карбону у молекулі бензолу утворюють правильний плоский шестикутник. Структурну формулу бензолу позначають правильним шестикутником із колом усередині.
Тобто атоми Карбону розміщуються в кутах шестикутника і сполучені з атомами Гідрогену. Кільце всередині шестикутника показує, що в молекулі існує єдина шестиелектронна хмара, утворена електронами, наданими у спільне користування шістьома Карбоновими атомами.
Зв’язки між атомами Карбону в молекулі бензолу не є простими чи подвійними в чистому вигляді. Тому вид зв’язку в молекулі бензолу називають ароматичним.
Гомологічний ряд бензолу має загальну формулу CnH2n-6.
За звичайних умов бензол - безбарвна, летка, вогненебезпечна рідина з характерним запахом. Кипить за температури 80 °С, у воді практично нерозчинний.
Бензол горить кіптявим полум’ям, утворюючи вуглекислий газ і воду. Особливий вид хімічного зв’язку в молекулі бензолу (ароматичний) обумовлює його стійкість проти дії окисників. Бензол не знебарвлює фіолетовий розчин калій перманганату.
Як і насичені вуглеводні бензол вступає в реакції заміщення. Це реакції галогенування і нітрування.
Реакції заміщення за участю бензолу відбуваються легше, ніж у насичених вуглеводнів. Так, при взаємодії бензолу з бромом при наявності каталізатора FeBr3 відбувається заміщення атома Гідрогену атомом Брому і утворюється бромобензол C6H5Br і бромоводень HBr.
C6H6 + Br2 C5H5Br + HBr
Продуктами іншої реакції заміщення - реакції нітрування - є нітробензол C6H5NO2 і вода.
C6H6 + HNO3 → C6H5NO2 + H2O
Як і ненасичені вуглеводні, бензол вступає в реакції приєднання. Це реакції хлорування при ультрафіолетовому освітленні
C6H6 + 3Cl2 C6H6Cl6
та реакція гідрування
C6H6 + 3H2 → C6H12
Реакції приєднання до бензолу проходять значно важче, ніж у ненасичених вуглеводнів. Щоб вони відбулися, потрібні особливі умови: підвищення температури і тиску, підбір каталізатора, світлове опромінювання та інше.
Так, з каталізатором - нікелем чи платиною - бензол приєднує водень, утворюючи циклогексан C6HC12. При ультрафіолетовому опромінювання бензол приєднує хлор, утворюючи гексахлорциклогексан C6H6Cl6.
Добувають бензол у лабораторії тримеризацією ацетилену, дегідруванням циклогексану та гексану. У великих кількостях бензол добувають із нафти і кам’яного вугілля під час їх переробки.
30.
Переглядів: 1060