
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Закон рівномірного розподілу енергії за ступенями вільності молекул
Для того, щоб визначити енергію, яка припадає на всі рухи молекул, необхідно ввести поняття про число ступенів вільності.
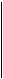 Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
У класичній статистичній фізиці виводиться закон Больцмана про рівномірний розподіл енергій за ступенями вільності молекул:
для статистичної системи, що перебуває у стані термодинамічної рівноваги, на кожний поступальний і обертальний ступінь вільності припадає в середньому кінетична енергія, що дорівнює 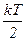 , а на кожний коливальний ступінь вільності – в середньому енергія
, а на кожний коливальний ступінь вільності – в середньому енергія 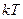 .
.
Коливальний ступінь має вдвоє
більшу енергію тому, що на нього припадає не лише кінетична енергія, як у разі поступального і обертального руху, але і потенціальна енергія, причому середні значення кінетичної і потенціальної енергій однакові:
 .
.
Таким чином, середня енергія молекули
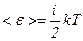 ,
,
де 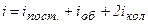 .
.
Важливою характеристикою термодинамічної системи є її внутрішня енергія
U – енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і тощо) і енергія взаємодії цих частинок.
В ідеальному газі немає сил взаємодії між молекулами, а, отже, дорівнює нулю взаємна потенціальна енергія молекул. Тому для моля ідеального газу внутрішня енергія дорівнює сумі кінетичних енергій  молекул:
молекул:
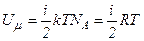 .
.
Якщо є 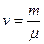 молів газу, то його внутрішня енергія
молів газу, то його внутрішня енергія
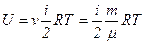 .
.
Внутрішня енергія ідеального газу залежить від кількості ступенів вільності молекул і абсолютної температури газу.
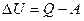 , або
, або 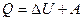 .
.
Це рівняння є математичним виразом першого закону термодинаміки:
теплота, надана системі, витрачається на збільшення її внутрішньої енергії і на виконання системою роботи проти зовнішніх сил.
Вираз для першого закону термодинаміки для нескінченно малої зміни стану системи матиме вигляд:
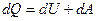
або в коректнішій формі
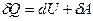 ,
,
де 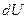 – нескінченно мала зміна внутрішньої енергії системи,
– нескінченно мала зміна внутрішньої енергії системи, 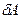 – нескінченно мала робота,
– нескінченно мала робота, 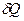 – нескінченно мала кількість теплоти. У цьому виразі
– нескінченно мала кількість теплоти. У цьому виразі 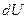 є повним диференціалом, а
є повним диференціалом, а 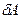 і
і 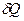 не є повними диференціалами, а функціоналами і залежать від вигляду функції, що описує перехід з одного стану в другий.
не є повними диференціалами, а функціоналами і залежать від вигляду функції, що описує перехід з одного стану в другий.
Дуже важливим є випадок, коли
система – це періодично діюча машина, в якій газ, пара або інше “робоче тіло” внаслідок деякого процесу повертається до початкового стану. У цьому разі
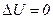 і
і 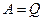 .
.
Робота, що виконується машиною за один цикл, дорівнює підведеній ззовні теплоті 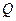 . Цей висновок дає змогу сформулювати перший закон термодинаміки так:
. Цей висновок дає змогу сформулювати перший закон термодинаміки так:
неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун першого роду неможливий).
Для характеристики теплових властивостей газу, як i будь-якого iншoгo тіла, користуються особливою величиною – теплоємністю.
Теплоємністю тіла називається фізична величина, яка числово дорівнює кількості теплоти, яку потрібно надати тілу, щоб підвищити його температуру на один кельвін:
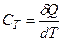 .
.
Значення 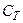 залежить від маси тіла, його хімічного складу, термодинамічного стану i виду процесу зміни стану тіла, в якому надходить теплота
залежить від маси тіла, його хімічного складу, термодинамічного стану i виду процесу зміни стану тіла, в якому надходить теплота 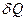 .
.
Питомою теплоємністю c називається фізична величина, що числово дорівнює кількості теплоти, яку слід надати одиниці маси цієї речовини для підвищення її температури на 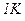 :
:
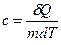 .
.
Молярною теплоємністю C називається фізична величина, яка числово дорівнює кількості теплоти, яку треба надати одному молю речовини для підвищення його температури на 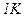 :
:
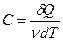 ,
,
де 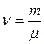 – кількість молей газу.
– кількість молей газу.
Між молярною теплоємністю 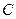 і питомою теплоємністю
і питомою теплоємністю 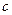 існує співвідношення:
існує співвідношення: 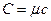 .
.
Якщо нагрівають газ, то згідно з
першим законом термодинаміки
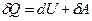 ,
,
а для одного моля газу
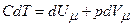 .
.
Якщо газ нагрівається при сталому об’ємі, то надана газу теплота йде лише на збільшення його внутрішньої енергії:
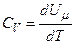 .
.
Якщо газ нагрівається при сталому тиску, то
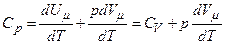 .
.
Тут враховано, що 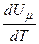 не залежить від виду процесу, оскільки внутрішня енергія ідеального газу не залежить ні від
не залежить від виду процесу, оскільки внутрішня енергія ідеального газу не залежить ні від 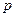 , ні від
, ні від 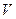 , а визначається лише температурою. Тому завжди
, а визначається лише температурою. Тому завжди 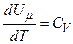 .
.
Згідно з рівнянням Клапейрона-Менделєєва
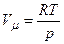 і
і 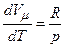 .
.
В результаті
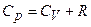 .
.
Отриманий вираз називається рівнянням Майєра.
Оскільки
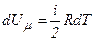 ,
,
то
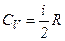 і
і 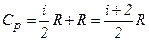 .
.
Кожний газ характеризується величиною
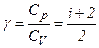 і
і 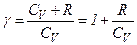 .
.
Звідси
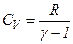 .
.
Отримані вирази для 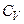 і
і  добре збігаються з експериментом для одноатомних і багатьох двоатомних газів при кімнатній температурі
добре збігаються з експериментом для одноатомних і багатьох двоатомних газів при кімнатній температурі 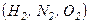 . Однак у
. Однак у 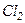
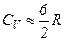 , що неможливо пояснити. У триатомних газів спостерігаються систематичні відхилення від теорії.
, що неможливо пояснити. У триатомних газів спостерігаються систематичні відхилення від теорії.
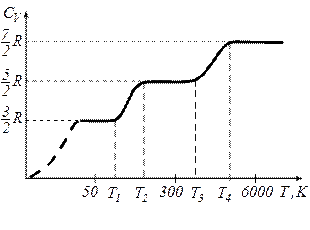
Експеримент показав, що теплоємність залежить від температури. Водночас згідно з формулами для 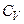 і
і  вона стала для даного газу.
вона стала для даного газу.
Графічно залежність теплоємності 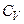 водню від температури показано на рисунку. При низьких температурах до температури
водню від температури показано на рисунку. При низьких температурах до температури 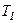
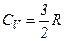 .
.
Ізопроцесами в газах називаються процеси, при яких один із основних параметрів стану  зберігається сталим.
зберігається сталим.
Ізохорний процес  .
.
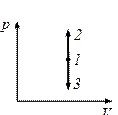 Діаграма цього процесу в координатах p, V зображається прямою, яка паралельна до осі ординат, де 1-2 – ізохорне нагрівання, а 1-3 – ізохорне охолодження
Діаграма цього процесу в координатах p, V зображається прямою, яка паралельна до осі ординат, де 1-2 – ізохорне нагрівання, а 1-3 – ізохорне охолодження
При ізохорному процесі газ не виконує роботи над зовнішніми тілами: δA=pdV=0.
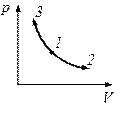 Отже, з першого закону термодинаміки δQ=dU+δA для ізохорного процесу випливає, що δQ=dU. Оскільки
Отже, з першого закону термодинаміки δQ=dU+δA для ізохорного процесу випливає, що δQ=dU. Оскільки
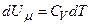 ,
,
то для довільної маси газу
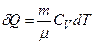 .
.
Ізобарний процес 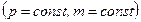 .
.
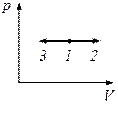 Діаграма цього процесу в координатах p, V зображається прямою, яка паралельна до осі V 1-2 – ізобарний процес розширення, 1-3 – ізобарний стиск.
Діаграма цього процесу в координатах p, V зображається прямою, яка паралельна до осі V 1-2 – ізобарний процес розширення, 1-3 – ізобарний стиск.
Робота, яку виконує газ при ізобарному розширенні від об’єму 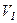 до
до 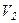 , дорівнює
, дорівнює
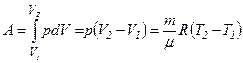 ,
,
де використано рівняння Клапейрона-Менделєєва.
При ізобарному процесі при наданні газу масою m кількості теплоти
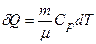
його внутрішня енергія зростає на величину
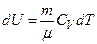 .
.
Газ виконує роботу
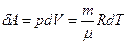 .
.
Ізотермічний процес 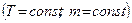 .
.
Діаграма цього процесу в координатах p, V є гіперболою. 1-3 – ізотермічний стиск, 1-2 – ізотермічне розширення
Робота газу при ізотермічному розширенні:
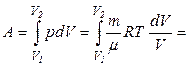
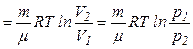 .
.
При 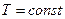 внутрішня енергія ідеального газу не змінюється, тобто
внутрішня енергія ідеального газу не змінюється, тобто
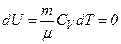 і
і 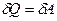 ,
,
тобто вся кількість теплоти, надана газу, витрачається на виконання ним роботи проти зовнішніх сил:
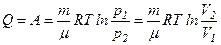 .
.
Робота розширення газу 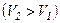 додатна. У випадку стиску газу (процес
додатна. У випадку стиску газу (процес 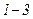 ) робота A, що виконується газом, від’ємна, водночас зовнішні сили виконують додатну роботу
) робота A, що виконується газом, від’ємна, водночас зовнішні сили виконують додатну роботу 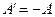 . При цьому
. При цьому 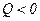 , тобто теплота від газу відводиться.
, тобто теплота від газу відводиться.
Переглядів: 3099