
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Фотометричні методи аналізу
План
Суть фотометричного аналізу і області його використання Спектр електромагнітного випромінювання в залежності від довжини хвиль ділять на декілька областей: Фотометричний метод аналізу ґрунтується на вибірковості поглинання розчину речовини ультрафіолетового, видимого і інфрачервоного світла. Інколи цей метод називають методом адсорбційної спектроскопії. Всі методи фотометричного аналізу високо чутливі і вибіркові; в них використовується різноманітна апаратура. Застосування: при контролі технологічних процесів, готової продукції: аналіз природних і хімічних матеріалів, у металургійній промисловості, аналіз гірських порід, природних вод; при контролі забруднення навколишнього середовища (повітря, води, ґрунту), при визначенні домішок у речовинах високої чистоти.
Теоретичні основи фотометричного аналізуВ більшості випадків при фотоколориметричних визначеннях компонент, що визначається, за допомогою хімічної реакції в розчині переводиться в сполуку, поглинаючу електромагнітне випромінювання, потім вимірюють його оптичну густину (адсорбційність). Суттєво важливо:
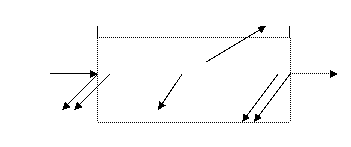
Оптичні властивості розчинів забарвлених сполукРозглянемо поглинання розчинами електромагнітного випромінювання у видимій області спектру. Безперервне електромагнітне випромінювання в області довжин хвиль 400 – 700 нм сприймається оком як біле світло. При проходженні через скляний сосуд з розчином монохроматичне випромінювання інтенсивністю W0 відбувається його ослаблення:
Інтенсивність пучка світла, що виходить з сосуду, – W. Проте на практиці користуються однаковими кюветами, для яких інтенсивність відбитої частини світлового потоку постійна і мала, тому нею можна знехтувати. Рівняння можна записати у вигляді: W0 = Wа + W Інтенсивність падаючого світлового потоку (W0) і інтенсивність світового потоку, що пройшов крізь розчин (W) можна виміряти. При освітленні розчину білим світлом вихідний пучок світла часто змінює забарвлення, оскільки інтенсивність поглинання розчину неоднакова для світлового випромінювання різних довжин хвиль. Таким чином, основними оптичними характеристиками розчинів забарвлених сполук в фотометрії є інтенсивність забарвлення і колір розчину.
Закон Бугера-Ламберта-БераДля забарвлених розчинів між ступенем поглинання монохроматичного світла. Інтенсивністю падаючого світла, концентрацією забарвленої речовини і товщиною шару існує залежність, яка називається законом Бугера-Ламберта-Бера. Закон Бугера-Ламберта-Бера: Розчини однієї і тієї ж забарвленої речовини при однаковій концентрації цієї речовини і товщині шару розчину поглинають рівну кількість світлової енергії. Прологарифмувавши це рівняння отримуємо Десятковий логарифм відношення інтенсивності падаючого світла до інтенсивності світла, що пройшло крізь розчин, називається оптичною густиною розчину (D). Крива залежності оптичної густини від концентрації забарвленої речовини:
Молярний коефіцієнт поглинання розчину Молярний коефіцієнт поглинання чисельно дорівнює оптичній густині розчину, концентрація якого дорівнює 1М при товщині шару 1 см.
Молярний коефіцієнт поглинання не залежить від концентрації. Він є мірою чутливості фотометричних реакцій. Чим більше значення, тим вище чутливість визначення.
ФотоколориметріяПри фотоколориметричних методах аналіз здійснюється по поглинанню поліхроматичного світла за допомогою фотоелементів. Прилади для фотоколориметрії – фотоколориметри або фотоелектроколориметри. В фотоколориметрах з’явилась можливість часткової монохроматизації спектру світлофільтрами. За допомогою світлофільтра обирають ділянку спектру в тій області довжин хвиль, де поглинання світла для даного розчину мінімальна. Світлофільтри для фотометрування обирають так, щоб максимум поглинання розчину відповідав максимуму пропускання світлофільтра. Таблиця. Колір розчину і відповідні їм світлофільтри.
Розрахунки при фотоколориметричних визначенняхОбчислення в фотометрії ґрунтуються на використанні формули:
Переглядів: 9955 Повернутися до змісту: Методи аналізу |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |
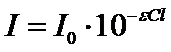
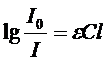 .
.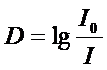 або
або 
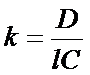
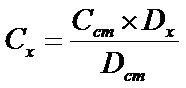 Сх – вміст йону в розчині
Сх – вміст йону в розчині