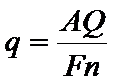РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кулонометричний аналіз
План
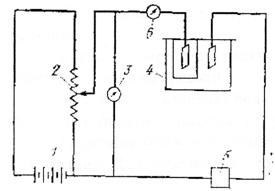
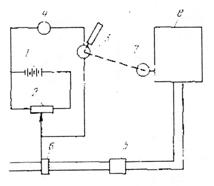
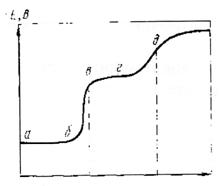
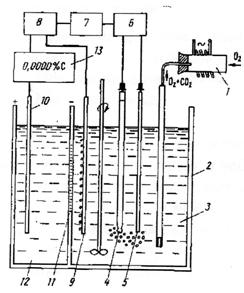
Суть методуКулонометричний метод ґрунтується на вимірюванні кількості електрики використаної в ході електрохімічної реакції з речовиною, що визначається. При проведенні електрохімічної реакції Непрямий кулонометричний метод (кулонометричне титрування) ґрунтується на отриманні реагуючих з речовиною, що визначається, йонів в самому титруємому розчині. Непрямий метод цінний тим, що дозволяє використовувати в якості титрантів нестійкі на повітрі розчини. Схема установки для кулонометричного аналізу при постійному потенціалі: 1- акумулятор; 2 – цілитель напруги; Струм від акумуляторної батареї 1 за допомогою ділителя напруги 2 при певному потенціалі, контрольованому вольтметром 3, подається на кулонометричну комірку 4. Кількість електрики, що пройшла через кулонометричну комірку, визначається кулонометром 5. Закінчення реакції в комірці визначається за спадом сили струму за допомогою міліамперметра 6. Принципова схема установки для кулонометричного титрування: Струм від постійного джерела 1 через потенціометр 2 поступає в комірку 4. Електроліз в цій комірці відбувається при постійній силі струму, що визначається гальванометром 3. Для стабілізації постійної сили струму. Що проходить через електролітичну комірку, використовують апмеростати. Доки при даних потенціалі і силі струму виділяється один з йонів, що визначається в розчині, потенціал і сила струму залишаються незмінними. Коли концентрація йону, що виділяється, зменшиться , то при даному потенціалі сила струму спаде. При цьому прийде в дію система регуляції, яка пересуває движок потенціометра до тих пір, доки сила струму не досягне попередньо заданого значення (ділянка бв). Точка в відповідає закінченню виділення першого металу, і час τ характеризує його кількість. Ділянка вг відповідає виділенню при майже постійному потенціалі другого металу, що міститься в досліджуваному розчині, яке закінчується в точці д, після чого йде електроліз фону. Час
Умови застосування методу Використання кулонометричного методу потребує виконання певних умов:
Експрес-аналізаторЦей спосіб дозволяє автоматизувати процес кулонометричного тирування. При фотометричному способі визначення кінцевої точки періодично переривають процес генерування титранта, відбирають частину електроліту і фотометрують, потім переносять відібрану порцію електроліту знову в комірку і продовжують титрування. Провівши таку операцію декілька разів, за отриманими даними будують графік залежності оптичної густини від часу електролізу (кількості отриманого титранта) і знаходять кінцеву точку звичайним шляхом.
Застосування кулонометріїКулонометрія використовується для розв’язання різних задач аналітичної хімії. Цим методом можна визначити еквівалентні маси, вивчати механізм реакції окиснення, комплексоутворення, досліджувати кінетичні і каталітичні процеси. Кулонометричний метод зручний для автоматизованих методів контролю, оскільки регулювати силу струму простіше, ніж регулювати надходження в реакційний сосуд титруючого розчину. Переглядів: 9568 Повернутися до змісту: Методи аналізу |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |