РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Титриметричний аналіз
План 1. Титриметричний аналіз, його класифікація
Титриметричний аналіз, його класифікаціяТитриметричним аналізом називається метод кількісного аналізу, в якому кількість досліджуваної речовини визначається шляхом точного вимірювання об’ємів реагуючих речовин. Реакції, які використовуються в титриметричному аналізі, повинні задовольняти такі вимоги:
Титриметричний аналіз в залежності від типу використаних хімічних реакцій ділять на такі групи:
Поняття про стандартні розчини. ТитрСтандартний розчин (титрований або робочий) – розчин речовини, яка вступає в реакцію з досліджуваною речовиною, що має точно відому концентрацію. Всі стандартні розчини титриметричного аналізу ділять на 2 типа: приготовані і встановлені. Приготованим стандартним розчином називають такий розчин, точна концентрація якого досягається в результаті його приготування: точну наважку розчиняють в мірній колбі. Титр такого розчину дорівнює масі наважки, поділеній на об’єм колби, в якій приготований розчин.
Встановлені стандартні розчини готують таким чином: спочатку готують розчин приблизної концентрації, а потім встановлюють його точну концентрацію шляхом титрування. Речовину, за якою встановлюють титр стандартного розчину, називають вихідною речовиною. Речовину, з якої приготований стандартний розчин, називається робочою речовиною.
Титрування та його видиПроцес додавання одного розчину до іншого до досягнення точки еквівалентності з метою визначення концентрації одного з них називається титруванням. Розрізняють пряме і зворотне титрування. При прямому титруванні досліджуваний розчин безпосередньо титрують стандартним розчином. Зворотне титрування застосовують тоді, коли досліджувана речовина не реагує зі стандартним розчином або реагує повільно. В цьому випадку до розчину приливають надлишок третього компонента і відтитровують стандартним розчином. Момент закінчення реакції, коли реагуючі речовини повністю прореагують називаються точкою еквівалентності.
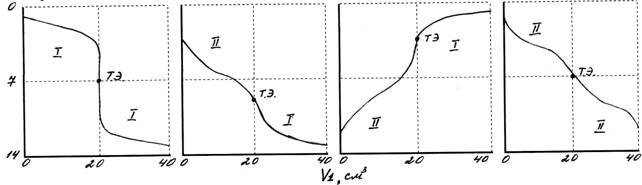
Метод нейтралізації Методом нейтралізації називається метод титриметричного аналізу, який ґрунтується на використанні реакції взаємодії йонів гідрогену і гідроксогрупи: Крива, яка виражає зміну значення рН титрованого розчину в залежності від об’єму прилитого робочого розчину називається кривою титрування. Горизонтальну лінію, яка проходить через точку, що відповідає рН=7, називають лінією нейтральності, а вертикальну, яка проходить через точку еквівалентності, - лінією еквівалентності. Форма кривої титрування буде визначатися характером взаємодії титрує мого і робочого розчину, тобто силою кислоти і лугу. Криві титрування: Точку еквівалентності можна також встановлювати за допомогою спеціальних приладів, наприклад рН-метрів в методах нейтралізації, потенціометрів при оксидиметрії.
ОксидиметріяОксидиметрія ґрунтується на використанні окисно-відновних реакцій. Робочими розчинами в оксидиметрії є розчини окисників і відновників. Кількісною характеристикою інтенсивності окисно-відновного процесу є різниця окисно-відновних потенціалів реагуючих між собою систем. Під час титрування окисно-відновний потенціал системи буде змінюватися, доки не буде досягнута точка еквівалентності. Для визначення кінцевої точки титрування в оксидиметрії застосовують окисно-відновні індикатори, або індикатором може слугувати сам реактив. А) перманганатометрія – метод, в якому головним робочим розчином є розчин перманганата калію.
Розрахунки в титриметричному аналізіОбчислення концентрації досліджуваної речовини здійснюється у відповідності до закону еквівалентів: V1N1=V2N2. Переглядів: 9605 Повернутися до змісту: Методи аналізу |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |