
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Закон еквівалентів
Поняття еквівалент має хімічне походження, але широко використовується у різних галузях науки та повсякденному житті. Воно використовується для позначення яких-небудь взаємозамінних величин. Так вартість будь-якого продукту пропорційна кількості витраченої на його виготовлення праці. Ілюстрацією закону еквівалентів є курс валют.
Хімічний еквівалент – частина атома, молекули або йона, яка припадає на одиницю валентності. По аналогії з відносною атомною масою та молярною масою розглядають відносну еквівалентну масу та молярну масу еквівалента з тими ж одиницями вимірювання:
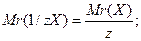
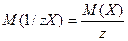 (г/моль), де
(г/моль), де
z – число еквівалентності.
Число еквівалентності у кислот дорівнює числу атомів Гідрогену, у основ – числу гідроксидних груп, у солей – сумарній валентності металу, у оксидів – сумарній валентності металу і Оксигену. Наприклад:
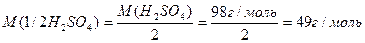
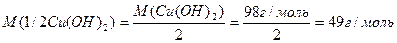
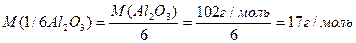
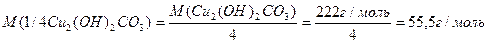 Такі обрахунки значень молярних мас еквівалентів можна вважати як формульними значеннями. Вони показують співвідношення мас елементів при утворенні вказаних молекул. Ці значення можуть відрізнятися при хімічній взаємодії речовин як в реакціях обміну, так і в окисно-відновних реакціях.
Такі обрахунки значень молярних мас еквівалентів можна вважати як формульними значеннями. Вони показують співвідношення мас елементів при утворенні вказаних молекул. Ці значення можуть відрізнятися при хімічній взаємодії речовин як в реакціях обміну, так і в окисно-відновних реакціях.
Реакції обміну – значеня молярної маси еквівалента кислоти, основи або солі може залежати від кількості частинок (функціональних груп), які обмінюються при реакції. Наприклад, формульне значення молярної маси еквівалента ортофосфатної кислоти:
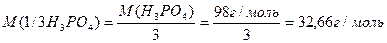
Розглянемо реакцію нейтралізації (обміну):
1. NaOH + H3PO4 = NaH2PO4 + H2O 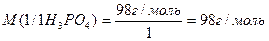
2. 2NaOH + H3PO4 = Na2HPO4 + 2H2O 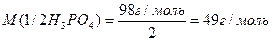
3. 3NaOH + H3PO4 = Na3PO4 + 3H2O 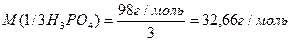
Отже числове значення молярної маси еквівалента речовин залежить від співвідношення вихідних речовин та продуктів, які утворюються.
При розрахунках за окисно-відновними реакціями число еквівалентності (z) дорівнює числу відданих чи приєднаних електронів.
Закон еквівалентів – речовини взаємодіють між собою у еквівалентних (тобто рівних) співвідношеннях, або маси речовин, які приймають участь у реакціях, відносяться між собою, як молярні маси їх еквівалентів.
А + 2В → АВ2
m(A) : m(B) : m(AB2) = M(1/zA) : M(1/zB) : M(1/zAB2)
Застосування закону еквівалентів суттєво спрощує розрахунки за хімічними рівняннями. При цьому важливий висновок із закону еквівалентів: з одним еквівалентом однієї речовини або елемента взаємодіє тільки один еквівалент іншої речовини або елементу. Цей закон був сформульований Ріхтером.
Хімічні речовини можуть існувати у чотирьох агрегатних станах: твердому, рідкому, газоподібному та плазмі. Агрегатний стан залежить від сили взаємодії молекул між собою. Для описання газоподібного агрегатного стану використовують закон Авогадро.
Закон Авогадро – у рівних об’ємах різних газів за однакових умов (температура та тиск) знаходиться однакова кількість молекул. Закон Авогадро виконується лише для газоподібних речовин. Це пояснюється особливостями цього стану речовин.
Висновок з закону Авогадро: молярний об’єм різних газів за нормальних умов (н.у.) величина постійна – 22,4 дм3/моль (22,4 л/моль) (н.у.: Т = 273 К, р = 101,3 кПа).
Густина твердих та рідких речовин (ρ, г/см3) – таблична величина. На відміну від них густина газів вимірюється в г/дм3 (г/л) та може бути розрахована за молярною масою та молярним об’ємом:
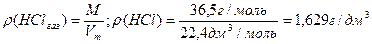
Для газів використовують також поняття відносної густини – відношення маси певного об’єму газу до маси такого ж об’єму іншого газу:
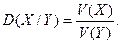 Це безрозмірна величина.
Це безрозмірна величина.
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- IV. Закони ідеальних газів.
- IV. Закономірності структурно-функціональної організації спинного мозку
- IV. СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ І ЗАКОНОДАВСТВА.
- А) Грошовий обіг. Закони.
- Авілум – “син чоловіка” – повноправна людина, охороні його життя, здоров’я, захисту його майнових інтересів присвячена значна частина законника.
- Аграрне право та законодавство США, Німеччини, Франції, Великої Британії, Ізраїлю, Польщі, Росії
- Аграрні закони України
- Адаптація законодавства України до законодавства ЄС - один із важливих інструментів створення в Україні нової правової системи та громадянського суспільства
- Адаптація законодавства України до законодавства ЄС - один із важливих інструментів створення в Україні нової правової системи та громадянського суспільства
- Адміністративна відповідальність за порушення аграрного законодавства
- Адміністративна відповідальність за порушення земельного законодавства
| <== попередня сторінка | | | наступна сторінка ==> |
| Завдання, предмет і значення загальної та неорганічної хімії | | | Короткі відомості про будову атома |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |