
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Короткі відомості про будову атома
Згідно планетарної моделі атома, яку запропонував в 1911 році англійський фізик Резерфорд, атом складається з позитивно зарядженого ядра та електронної оболонки, електрони в електронній оболонці рухаються навколо ядра (за Резерфордом) в певних орбітах. Об’єм ядра складає одну стотисячну частину від загального об’єму атома. У 1932 році було доведено, що ядро складається з нуклонів. Існує два види нуклонів: позитивно заряджені протони та електронейтральні нейтрони. Маса протонів та нейтронів майже однакова і приблизно дорівнює 1 а. о. м. Протони та нейтрони зв’язані між собою ядерними силами, які в тисячу разів більш міцні ніж хімічні зв’язки між атомами.
У 1913 році англійський вчений Мозлі при вивченні рентгенівських спектрів атомів довів, що позитивний заряд ядра атома дорівнює порядковому номеру елемента в періодичній системі елементів. Так як заряд ядра обумовлений наявністю протонів, то кількість протонів дорівнює порядковому номеру.
Атоми є незарядженими частинками. Це обумовлено тим, що поряд з позитивно зарядженим ядром в атомі існує електронна оболонка, яка складається з негативно (від’ємно) заряджених електронів. Отже, кількість електронів дорівнює кількості протонів, а також порядковому номеру елемента.
m(ē)=1/1837 а.о.м.
Заряд ядра атома є найважливішою характеристикою елемента, він є незмінним. А кількість нейтронів може бути різною у атомів одного і того ж елемента. В залежності від співвідношення кількості протонів та нейтронів в атомах одного елемента вони поділяються на ізотопи, ізобари та ізотони.
Ізотопи – атоми одного хімічного елемента, які мають різну кількість нейтронів. Наприклад, ізотопи Гідрогену – 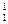 Н (або Протій),
Н (або Протій), 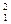 Н (або D – Дейтерій),
Н (або D – Дейтерій), 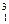 Н (або Т – Тритій). Цифрою знизу позначається заряд ядра елемента, а цифра зверху – масове число елемента або сума протонів та нейтронів. Ядра всіх цих ізотопів мають у складі по одному протону, а нейтронів в атомі Протію немає, в атомі Дейтерію – 1, а в атомі Тритію – 2.
Н (або Т – Тритій). Цифрою знизу позначається заряд ядра елемента, а цифра зверху – масове число елемента або сума протонів та нейтронів. Ядра всіх цих ізотопів мають у складі по одному протону, а нейтронів в атомі Протію немає, в атомі Дейтерію – 1, а в атомі Тритію – 2.
Ізобари – атоми різних елементів, які мають однакову атомну масу. Кількість протонів та нейтронів в атомах ізобарів різна. Наприклад, відомі ізобари Аргону та Калію з масовим числом 40: 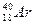 та
та 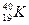 .
.
Ізотони – атоми різних елементів, які мають однакову кількість нейтронів. Наприклад, 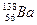 та
та 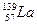 .
.
Радіоактивність
Ізотопи хімічних елементів поділяються на стабільні та радіоактивні.
Стабільні ізотопи існують незмінними у часі, а радіоактивні випромінюють заряджені або незаряджені частинки з ядра. При цьому в більшості випадків відбувається зміна природи атомів, тобто перетворення одного елемента в інший.
Явище радіоактивності було відкрите французьким фізиком А. Беккерелем в 1896 р. При радіоактивних випромінюваннях ядра здатні випромінювати такі частинки :
1. α-Промені, які мають незначну проникаючу дію, заряджені позитивно. α-Частинка складається з двох протонів та двох нейтронів, тобто подібна за складом до ядер гелію.
2. β-Частинки мають значно більшу проникаючу дію ніж α-частинки. Доведено, що за природою β-частинки – електрони, які мають високу швидкість руху.
3. γ-Промені мають дуже велику проникаючу дію. Це електромагнітні хвилі дуже маленької довжини, близькі за довжиною до рентгенівського випромінювання – біля декількох нанометрів.
Крім перелічених частинок радіоактивні ядра здатні випромінювати нейтрони, протони, нейтріно, позитрони.
Радіоактивні перетворення речовини не є хімічними процесами, їх вивчає ядерна фізика. Це пояснюється тим, що при радіоактивних явищах змінюється склад ядер атомів, а при хімічних реакціях відбувається перебудова лише зовнішніх електронних оболонок атомів. Склад ядра при цьому залишається незмінним. В той же час ядерні перетворення записують у вигляді рівнянь, які відрізняються від рівнянь хімічних реакцій. В основі рівнянь хімічних реакцій лежить закон збереження маси, тобто в вихідних речовинах і в продуктах реакції знаходиться однакова кількість атомів одних і тих же елементів. При ядерних перетвореннях вихідні речовини мають атоми одних елементів, а утворюються атоми інших елементів. Різними можуть бути також елементарні частинки, які бомбардують вихідні речовини та утворюються в результаті процесу. Якщо перевірку вірності написання рівнянь хімічних реакцій проводять, виходячи з закону збереження маси, то в ядерних реакціях перевіряють кількість нуклонів та кількість зарядів в правій та лівій частині рівняння.
Приклади процесів радіоактивного перетворення:
1) α-розпад
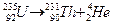
2) спонтанний поділ ядер
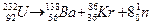
Читайте також:
- IX. Відомості про військовий облік
- IX. Відомості про військовий облік
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Атомарний рівень будови речовини
- Багатоманітність і взаємодія культур
- Білковий обмін: загальні відомості
- Біографічні відомості
- Боротьба з проявами національної самосвідомості
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова електронної оболонки атома
- Будову амортизатора
| <== попередня сторінка | | | наступна сторінка ==> |
| Закон еквівалентів | | | Будова електронної оболонки атома |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |