
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Будова електронної оболонки атома
Під час хімічних реакцій змінюється будова лише зовнішніх електронних шарів атома. Тому хімічні властивості елементів обумовлені особливістю будови електронної оболонки. Поняття орбіта руху електрона замінили на орбіталь руху.
Орбіталь – це об’єм простору, в якому зосереджено біля 95 % ймовірності перебування електрона в атомі.
Вирішення основного рівняння квантової механіки (Е. Шредінгер) для атома Гідрогену дало можливість визначити безрозмірні параметри, за допомогою яких була розрахована енергія електрона в атомі та характер його руху. Знайдені параметри називаються квантовими числами. Для кожного електрона атома існує чотири квантових числа.
Отже з позицій сучасної науки структура електронної оболонки спрощено може бути зображена так:
1. Електронна оболонка атома складається з електронних шарів (електрони в шарі мають майже однакове значення енергії, однакове значення головного квантового числа – n).
2. Електронні шари складаються з підшарів (вони мають однакове значення орбітального квантового числа – l).
3. Підшари складаються з певної кількості орбіталей (їх кількість співпадає із кількістю значень магнітного квантового числа – m).
4. В кожній орбіталі може рухатись один або два електрони (їм відповідає значення спінового квантового числа – ms).
Фізичний зміст квантових чисел
1. Головне квантове число позначається – n, має значення 1, 2, 3, 4, 5, 6, 7…
У реально існуючих атомів у незбудженому стані n може мати значення від 1 до 7. При дії на атом сильного йонізуючого поля електрон відривається від атома, значення n прагне до нескінченності.
Значення n визначає більшу частину енергії електрона – чим більше n, тим більше власна енергія електрона та більш слабко він взаємодіє з ядром.
Загальне значення (Езаг.) енергії всех електронів в одному атомі однакове. Але в той же час всі електрони по різному взаємодіють з ядром і по різному розташовані в електронній оболонці. Загальну енергію електрона можна уявити як суму енергії взаємодії з ядром (Евз.) та власної енергії електрону (Евласн.):
Езаг. = Евз. + Евласн.
Чим ближче до ядра електрон, тим більше Евз. і менше Евласн..
Значення n визначає собою розміри орбіталі – чим більше n, тим більше радіус орбіталей.
Електрони з однаковим значенням n мають майже однакову енергію і утворюють електронний шар. Якщо n = 1, це перший від ядра електронний шар, при n = 3, третій та ін.
За цифровим значенням n можна обрахувати максимально можливу кількість електронів у певному електронному шарі за формулою: N = 2n2.
В періодичній системі головне квантове число означає собою номер періоду, у елементів якого починає заповнюватись відповідний електронний шар. Тобто у елементів першого періоду починає формуватись перший електронний шар, у елементів третього періоду – третій та ін. Лише у елементів першого та другого періодів закінчується добудова першого та другого електронних шарів на протязі періоду.
2. Орбітальне квантове число (його ще називають побічним або азимутальним) характеризує кількість та природу електронних підшарів, з яких складаються електронні шари. Це число позначається l, кількість його значень l =1, 2, 3…(n – 1). Кожному цифровому позначенню l відповідає літерне. Отже, можна сказати, що маємо електрон на підрівні, у якого l =1, або електрон s-підрівня:
0 1 2 3
 l
l
 s р d f
s р d f
Кількість значень побічного квантового числа завжди дорівнює номеру електронного шару (рівня). Це означає, що перший електронний шар складається з одного підшару (s), другий шар має два підшари, третій – три підшари тощо.
3. Магнітне квантове число визначає орієнтацію орбіталей у просторі, позначається m. Кількість значень магнітного числа дорівнює m = -l…0…+l
Кожному значенню магнітного квантового числа відповідає одна орбіталь.
4.Спінове квантове число ms – характеризує особливості руху електрону в орбіталі. Воно має лише два значення +1/2 та -1/2.
Таким чином, стан електрону в атомі будь-якого хімічного елемента може бути описаний за допомогою чотирьох квантових чисел (табл. 1.1).
Таблиця 1.1 – Головне квантове число, типи та число орбіталей, а також максимальне число електронів на підрівнях та рівнях
| Енерге-тичний рівень n | Число підрівней, що дорівнює n | Орбіталі | Число орбіталей | Максимальна кількість електронів | ||
| на під- рівні | на рівні, що дорівнює n2 | на під- рівні | на рівні | |||
| K (n = 1) | 1s | |||||
| L (n = 2) | 2s 2p | |||||
| M (n = 3) | 3s 3p 3d | |||||
| N (n = 4) | 4s 4p 4d 4f |
У реально існуючих атомів повністю заповненими можуть бути лише чотири електронних шари. Всі останні є недобудованими.
Електронні формули – це запис структури електронної оболонки за допомогою квантових чисел. Наприклад, для 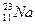 електронна формула 1s22s22p63s1.
електронна формула 1s22s22p63s1.
З електронних формул видно, що всі елементи можна поділити на певні групи, їх назвають електронними родинами, Отже за ознакою розміщення останнього електрона на певному підшарі всі елементи розділяють на s-, р-, d-, f-електронні родини. Елементи певних родин мають подібну структуру
електронних оболонок, а також повну аналогію будови валентних електронних шарів.
У s- та р-електронних родин валентним є зовнішній електронний шар, а у d- та f-родин валентними є електрони зовнішнього та частково другого ззовні електронних шарів.
1.6. Періодична система елементів
Д. Менделєєв виявив спільне, що характеризує всі хімічні елементи. Це дало змогу знайти логічний зв’язок між усіма хімічними елементами, сформулювати періодичний закон та створити періодичну систему (ПС), як табличний вираз періодичного закону:
“Властивості простих речовин, а також форми та властивості сполук хімічних елементів знаходяться у періодичній залежності від величини атомної маси елементів”.
У незмінному вигляді періодичний закон проіснував до 1913 р., коли видатний англійський вчений Мозлі на основі аналізу рентгенівських спектрів атомів виявив, що порядковий номер хімічного елемента у ПС дорівнює заряду його ядра. Стало зрозумілим, що заряд ядра атома є більш фундаментальною характеристикою ніж атомна маса. Після цього відкриття формулювання періодичного закону уточнили: “Властивості простих речовин, а також форми та властивості сполук хімічних елементів знаходяться у періодичній залежності від заряду ядра атома”.
Новим тріумфом періодичного закону та ПС стало відкриття фізиками квантової теорії та розрахунок квантових чисел. Квантові числа знайшли свій прояв у структурі ПС і перестали бути абстракцією: головне – це номер періоду та номер електронного шару, який починає заповнюватись у елементів цього періоду. Орбітальне квантове число проявляється у різнокольоровому забарвленні елементів певної електронної родини – це елементи, у яких відбувається заповнення підшарів певного електронного шару, а кількість електронів у підшарі та елементів у родині – це прояв магнітного та спінового квантових чисел.
Таким чином, можна вважати, що ПС – є діюча модель існування саме такої взаємодії між частинками мікросвіту, яка передбачається квантовою механікою. Це є також ілюстрацією тісного переплетіння фізичних закономірностей з хімічними властивостями елементів. Велика кількість варіантів періодичної системи – це спроба виявити нові зв’язки між елементами та їх властивостями, які ще не відкриті.
Структура періодичної системи
Період – це горизонтальний ряд (або ряди) хімічних елементів, що починається ns1-елементом, а закінчується ns2nр6-елементом.
Група – вертикальний ряд елементів, який поділяється на дві підгрупи, що складаються із елементів, які є атоманалогами. Атоманалоги – елементи, які мають однакову будову зовнішнього електронного шару. Таке визначення для групи характерно для короткоперіодного варіанту ПС, їх 8. У довгоперіодному варіанті групи складаються лише з атоманалогів.
1, 2, 3 періоди ще мають назву малі, вони включають так звані типові елементи; 4, 5, 6 періоди – великі, вони мають 2 або 3 ряди; 7 період –незакінчений.
В періодах відбувається поступова зміна кількості електронів на зовнішньому електронному шарі (s- та р-елементи), або на другому ззовні (d-елементи). У f-елементів відбувається заповнення третього ззовні електронного шару. Валентні електрони знаходяться у елементів s- та р-електронних родин на зовнішньому, у d- та f-елементів на першому та частково другому ззовні електронному шарі. Отже, у f-елементів заповнюється не валентний, а внутрішній електронний шар. Це є причиною того, що f-елементи мають дуже подібні хімічні властивості і їх важко виділити із сумішей.
Таким чином, з періодичного закону ми знаємо, що хімічні властивості елементів змінюються періодично. Причиною є певна обмежена ємність електронних шарів та їх підшарів.
Періодичність властивостей хімічних елементів
Всі властивості хімічних елементів, які визначаються будовою електронної оболонки атома, закономірно змінюються у періодичній залежності. При цьому у елементів–аналогів будова електронної оболонки подібна, але нетотожня. Тому у групах та підгрупах спостерігається не простий повтор властивостей, а закономірна зміна.
Електрони зовнішніх електронних шарів, які при хімічних реакціях відщеплюються або приймають участь в утворенні ковалентного зв’язку, називаються валентними електронами. Атоми металів на зовнішньому електронному шарі у більшості випадків мають від одного до трьох електронів. Ці електрони порівняно слабко притягуються ядром, тому атоми металів при хімічних реакціях віддають свої валентні електрони, перетворючись у позитивно заряджені йони. Це є характерною особливістю усіх металів. Чим легше метал віддає електрони, тим він більш активний, легше вступає в хімічні реакції. Мірою реакційної здатності металу є його енергія йонізації.
Енергія йонізації – це енергія, яку треба витратити на відрив електрона від нейтрального атома та перетворення його на йон з позитивним зарядом. Енергія йонізації вимірюється у кДж\моль·атом або еВ\атом.
Графік залежності першого потенціалу йонізації в залежності від порядкового номера має явно виражений періодичний характер. Найменший потенціал йонізації у лужних металів, найбільший – у інертних газів. Зліва направо по періоду енергія йонізації змінюється немонотонно. Немонотонність зміни енергії йонізації у періоді пояснюється проявом принципу найменшої енергії, яку мають підшари заповнені повністю або наполовину заповнені.
Екранування – це ефект, який пояснюється взаємодією між електронами – електрони внутрішніх шарів відштовхують зовнішні тому, що мають однаковий заряд.
Ефект проникнення електронів до ядра обумовлений тим, що всі електрони певну кількість часу перебувають біля ядра (у визначенні орбіталі ймовірність перебування електрона у орбіталі дорівнює 95%). При цьому вважається, що ефект проникнення найбільший для s-електронів, найменший для f-електронів.
Атоми неметалів у більшості випадків на зовнішньому електронному шарі мають від чотирьох до семи електронів. При хімічних реакціях атоми неметалів переважно приєднують до себе електрони інших атомів, перетворюючись при цьому в негативно заряджені йони. Тому, що найбільш стабільний стан атома характеризується наявністю на зовнішньому шарі октету (вісім електронів). Таким чином, самою характерною властивістю неметалів є їх здатність приєднувати електрони під час хімічних реакцій. Мірою проявлення неметалічних властивостей є спорідненість до електрону.
Спорідненість до електрона – це енергія, яка випромінюється при приєднанні електрона до нейтрального атома, вимірюється у кДж/моль·атом або у е·В/атом.
Якщо енергія йонізації знайдена для всіх елементів, то спорідненість до електрона експериментально визначена лише для небагатьох елементів, а для інших визначена методом екстраполяції.
Виходячи з викладок квантової механіки про дуалістичний характер руху електрона, точно виміряти розміри атомів неможливо. Тому за радіус атома прийнято вважати приблизну відстань від ядра до головного максимуму густини електронної хмари – це орбітальний радіус. У кристалічних гратках визначають ефективні радіуси – відстань між ядрами зв’язаних атомів поділена на 2. Характер залежності атомних та йонних радіусів від заряду ядра – періодичний.
У періодах – радіус атома зменшується, тому що зростає кількість електронів на зовнішньому шарі і сила взаємодії їх з ядром. Найбільш значне зменшення радіуса атома спостерігається у елементів малих періодів. У великих періодах радіус атома зменшується більш повільно – це називають d- та f-стискуванням.
У підгрупах, в цілому, зверху вниз радіус атома збільшується, тому що збільшується кількість електронних шарів. У s- та р-елементів зміна радіуса атома більш різко, ніж у d- та f-елементів.
Таким чином:
1. Періодичність зумовлена обмеженою кількістю електронів у шарі, при цьому відбувається повторення будови валентного електронного шару та обумовлених нею хімічних властивостей елементів. Або періодичність зумовлена повторенням електронних конфігурацій атомів.
2. Властивості елементів та їх сполук закономірно змінюються як по горизонталі (у межах періодів), так і по вертикалі (у межах груп і підгруп). Крім того, спостерігається ще й діагональна подібність елементів (Li-Mg, Na-Ca, Be-Al).
3. Порядковий номер елемента вказує на заряд ядра Z (протонне число) і кількість електронів в атомі.
4. Номер періоду дорівнює кількості електронних шарів в електронній оболонці атома.
5. Номер групи, як правило, вказує на найвищу можливу ступінь окиснення.
6. Всі s-, d-, f-елементи є металами. Лише р-елементи поділяються (в короткоперіодичному варіанті ПС) діагоналлю від Be до At на метали – зліва внизу та неметали – зправа вверху.
7. Металічні властивості зменшуються зліва направо по періоду.
8. Металічні властивості зростають зверху вниз по групі.
9. Приблизно по діагоналі (Be – At) розміщені елементи, які виявляють амфотерні властивості (Be, Al, Cr, As, Sn, Pb та ін.).
Читайте також:
- I. Оболонки та підоболонкові порожнини головного мозку
- II. Будова доменної печі (ДП) і її робота
- А. Оболонки очного яблука
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Анатомічна будова кістки
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
- АСОЦІАЦІЯ. ПОБУДОВА АСОЦІАТИВНОГО КУЩА
- Атмосфера. ЇЇ хімічний склад та будова
| <== попередня сторінка | | | наступна сторінка ==> |
| Короткі відомості про будову атома | | | Хімічний зв’язок. Будова молекул |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |