
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічний зв’язок. Будова молекул
Розгляд будови атома та структури періодичної системи є необхідним для подальшого вивчення самої сутності хімічних реакцій, що що полягає в утворенні хімічних зв’язків між атомами. За допомогою хімічних зв’язків утворюються молекули, тобто нові речовини.
Причиною утворення хімічних зв’язків є енергетична нестабільність атомів, у яких є недобудовані електронні шари, або на зовнішньому електронному шарі кількість електронів менше 8.
Хімічний зв’язок – це взаємодія поміж атомами, яка супроводжується перебудовою зовнішніх (валентних) електронних оболонок та випромінюванням енергії.
Розрізняють чотири типи хімічного зв’язку: ковалентний, йонний, водневий, металічний.
Основні параметри хімічного зв’язку: довжина, валентний кут, енергія зв’язку.
Довжина зв’язку – це відстань між ядрами атомів, які утворюють зв’язок, вона вимірюється у нанометрах.
Кут зв’язку вимірюють у випадках, коли в молекулі не менше трьох атомів. Це кут між умовними лініями, які з’єднують центри атомів.
Енергія зв’язку є важливою характеристикою, вимірюється в кДж/моль. При утворенні хімічного зв’язку між атомами енергія завжди випромінюється. Чим міцніший утворюється зв’язок, тим більше енергії випромінюється при його утворенні.
Електронегативність – це здатність атомів притягувати до себе сторонні електрони. Найбільш поширена методика оцінки електронегативності запропонована Л. Полінгом. Найбільш електронегативний Флуор має електронегативність 4, найменш електронегативний Цезій – 0,7.
Ковалентний зв’язок
Хімічний зв’язок утворюється лише тоді, коли при наближенні двох атомів (або декількох) повна енергія утвореної системи зменшується, отже частина енергії, яку мали атоми до об’єднання випромінюється. Всі типи хімічного зв’язку мають подібність. Але кожний тип має свої особливості, які обумовлюють появу нових властивостей. Першою теорією хімічного зв’язку була теорія Льюіса, яка передбачала виникнення спільних для двох атомів електронних пар. Це положення є основою теорії ковалентних зв’язків.
Ковалентні зв’язки виникають між атомами, які або мають однакову електронегативність (виникає неполярний зв’язок: Н2, Сl2) або між атомами, які мають близьку за значенням електронегативність (полярний зв’язок: Н2О, СО2).
Ковалентний зв’язок утворюється за двома механізмами:
1. Обмінний механізм – кожен з атомів на утворення зв’язку витрачає по одному неспареному електрону.
2. Донорно-акцепторний зв’язок – один атом надає неподілену електронну пару (донор), другий атом витрачає порожню орбіталь (акцептор).
Для ковалентного зв’язку характерні особливості – насиченість (насичуваність), напрямленість, поляризовність.
Насиченість (насичуваність) ковалентного зв’язку. Насиченість (насичуваність) показує, що атом утворює не будь-яке, а обмежене число зв’язків – не більше, ніж орбіталей у валентному шарі.
Напрямленість ковалентного зв’язку. Електронні орбіталі s-, р-, d-, f-типу мають різну просторову форму, тому в залежності від їх форми, а також способу перекривання утворюються σ- та π-зв’язки.
σ-Зв’язки мають найбільшу область перекривання орбіталей, тому вони мають найбільшу міцність. Область перекривання орбіталей при утворенні σ-зв’язків розміщена на прямій, яка проходить через центри атомів, що утворюють зв’язок. У випадках утворення σ-зв’язку р-орбіталями, які орієнтовані у просторі за Декартовими координатами, то і хімічні зв’язки утворені ними просторово напрямлені. Ще більше обумовлена напрямленість π-зв’язків. При утворенні π-зв’язків утворюються дві області перекривання орбіталей, які розміщені поза лінією, що зв’язує ядра атомів.
Для пояснення особливостей утворення зв’язків одна з гіпотез –гібридизація орбіталей. Вважають, що при утворенні зв’язків у молекулі за рахунок участі орбіталей різного типу відбувається їх взаємодія та зрівнювання енергії орбіталей та зміни їх форми (рис. 1.1).
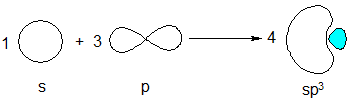
Рис. 1.1. Гібридизація атомних орбіталей
Гібридизована орбіталь більше витягнута по один бік від ядра. Змінена форма орбіталі не дає можливості перекриватись по типу π-зв’язку. Отже гібридизовані орбіталі не здатні утворювати π-зв’язки.
Поляризовність ковалентного зв’язку. Зв’язок між двома різними атомами завжди більш, чи менш полярний тому, що більш електронегативний атом зміщує до себе електронну густину. Наприклад, у молекулі гідроген хлориду на атомі Хлору зосереджений негативний заряд. Отже, атом Гідрогену в цій молекулі заряджений позитивно. Для передбачення реакційної здатності молекул важливо знати не лише первинне розміщення електронної густини, але і здатність до її зміни.
Поляризовність зв’язку – здатність зміни його полярності під дією зовнішнього електричного поля. Кожен атом або молекула має своє електричне поле, тому вони впливають один на одного. В результаті поляризації може відбутись розрив електронної пари між атомами, при якому електронна пара переходить до одного з атомів з утворенням негативно зарядженого йона та позитивного йона. Так діють молекули води на молекули гідроген хлориду при розчиненні у воді.
Йонний зв’язок
При взаємодії атомів, у яких різниця в електронегативності більше 1, електрон може повністю переходить до більш електронегативного атома, утворюючи йони (позитивний чи негативний).
Причиною утворення йонного зв’язку є подальша електростатична взаємодія між протилежно зарядженими йонами згідно закону Кулона.
На відміну від ковалентного, йонний зв’язок є ненасиченим та ненапрямленим.
Йонна гратка натрій хлориду має послідовне чередування йонів Натрію та Хлору. Тому кожен йон Натрію оточений шістьма йонами Хлору. Енергія цих зв’язків однакова. Отже, атом Натрію віддає на утворення зв’язку один електрон, а утворюються шість зв’язків між протилежно зарядженими йонами. У цьому полягає ненасиченість йонного зв’язку.
При руйнуванні речовин з йонною граткою утворюються не молекули, а йони. Це відбувається як при електролітичній дисоціації, так і при термічній дисоціації речовин. Тому для речовин з йонною кристалічною граткою поняття молекула замінили на поняття “формульна одиниця”, яке подібно молекулярній формулі відображає якісний склад речовини та кількісне співвідношення атомів в речовині.
Водневий зв’язок
Атом Гідрогену може не лише утворювати ковалентний зв’язок, а й перебуваючи у ковалентно зв’язаному стані утворювати додатково водневий зв’язок. Саме у ковалентно зв’язаному стані атом Гідрогену має здатність взаємодіяти з іншими атомами, у яких є неподілені електронні пари (атоми Оксигену, Нітрогену, Флуору). Атом Гідрогену при утворенні ковалентного зв’язку і відтягуванні від атома електрона перетворюється на майже голий протон – частинку з дуже малим радіусом та достатньо великим позитивним зарядом. Ця частинка має велику густину заряду на поверхні. Вона притягується до неподіленої електронної пари іншого атома.
Саме такі зв’язки обумовлюють структуру води, білків, спиртів. Велику роль відіграє водневий зв’язок у біологічних процесах. За своєю енергією (80-150 кДж/моль) водневий зв’язок є проміжним між міжмолекулярним та більш міцним – хімічним. Внаслідок невеликої міцності водневі зв’язки легко руйнуються за звичайної температури.
Металічний зв’язок
Для металів характерні такі фізичні властивості як велика теплопровідність та електропровідність, також у звичайних умовах всі (за винятком ртуті) є твердими сполуками. У вузлах кристалічних граток металів знаходяться позитивно заряджені йони, а між ними рухається електронний газ, який складається з валентних електронів. Це спрощене трактування металічного зв’язку.
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- VI. РАДІАЦІЙНИЙ, ХІМІЧНИЙ, БІОЛОГІЧНИЙ ЗАХИСТ
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Алкіни – вуглеводні, в молекулах яких є два атоми вуглецю, сполучені потрійним зв’язком - -. Алкіни називають також ацетиленовими вуглеводнями.
- Анатомічна будова кістки
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
- АСОЦІАЦІЯ. ПОБУДОВА АСОЦІАТИВНОГО КУЩА
| <== попередня сторінка | | | наступна сторінка ==> |
| Будова електронної оболонки атома | | | Розчини |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |