
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Это уравнение – математическое выражение первого закона термодинамики.
Цей метод використовується в усіх областях науки і промисловості. Найбільш широке використання для аналізу природної води, стічних та промислових вод. Його використовують для дослідження річних, мррських вод, атмосферних опадів та інших екологічних досліджень.
Цим методом виявляють залишки в біоматеріалах і грунті. Так визначають сліди елементів: кадмію, хрому, танталу, свинцю в крові при вмісті 10-4%, його використовують при кількісному аналізі ліків.
Химическая термодинамика изучает тепловые эффекты химических процессов; позволяет определить возможность, направление и глубину протекания химического процесса в конкретных условиях.
Предметом изучения термодинамики является термодинамическая система.
Система– это тело или группа тел, или совокупность веществ находящихся во взаимодействии и обособленных от окружающей их внешней среды.
Между системой и внешней средой существует истинная и условная граница раздела.
Термодинамические системы бывают гомогенные, которые имеют один и тот же состав и одинаковые свойства во всех точках объёма и гетерогенные. Они состоят из нескольких гомогенных фаз отделенных друг от друга поверхностями раздела, на которых некоторые свойства меняются скачком. Насыщен раствор с осадком NaCl.
Фазой – называется гомогенная часть гетерогенной системы, отделённая от других её частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Вещества, входящие в состав фаз, называются компонентами, или составными частями системы, они могут быть выведены из системы и существовать вне её. Системы могут по-разному взаимодействовать с внешней средой.
закрытые, не обмениваются веществом с внешней средой и другими системами. Например, закрытый герметично стакан с горячим чаем. В этом случае обмен веществом невозможен, но тепло через стенки стакана передаётся окружающей среде, закрытый сосуд с реагирующим веществом;
открытые, обмениваются и веществом и энергией с внешней средой и др. системами. Например, открытый стакан с горячим чаем. Такая система обменивается с внешней средой и теплом и веществом (парами воды), горящая спичка, работающий двигатель, растущее дерево.
изолированные, не обмениваются с внешней средой ни энергией, ни веществом, и имеет постоянный объём. В природе не существует изолированных систем. Понятие изолированная система это чисто теоретическое построение.
В каждый момент времени состояние системы характеризуется термодинамическими параметрами состояния, то есть какими-то физическими свойствами. Термодинамические параметры состояния: температура, давление, объём и концентрация.
Совокупность параметров состояния определяет термодинамическое состояние системы.
Всякое изменение состояния системы, связанное с изменением хотя бы одного параметра, называется термодинамическим процессом.
Совокупность промежуточных состояний, через которые проходит система, называется путём процесса. Различают пути процесса:
1) Изобарный (P = соnst);
2) Изохорный (V = соnst);
3) Изотермический (Т= соnst);
4) Изобарно-изотермический (P и Т= соnst);
5) Изохорно-изотермический (V и Т= соnst);
6) Адиабатный, в котором отсутствует обмен теплом между системой и внешней средой, но может быть связь работой.
Каждую систему можно описать с помощью уравнений газовых законов.
Состояние системы и происходящие в ней изменения характеризуются также с помощью функций состояния, зависящих от параметров состояния и не зависящих от пути перехода системы из одного состояния в другое. К функциям состояния относятся: внутренняя энергия (U), энтальпия (Н), энтропия (S), энергия Гиббса(G) и энергия Гемгольца (F)
Под внутренней энергией понимают энергию, которая в скрытой форме заключена в каждом теле и которая складывается из кинетической энергии движения всех составляющих систему частиц (молекул, атомов, электронов, ядер) и потенциальной энергии их взаимодействия. Внутренняя энергия не включает в себя потенциальную энергию, обусловленную положением системы в пространстве, и кинетическую энергию движения системы как целого.
Внутренняя энергия – функция состояния, – её значение зависит от начального и конечного состояния системы и не зависит от пути перехода системы.
Абсолютную величину внутренней энергии системы определить пока невозможно и так как неизвестным остаётся значениеU0 ( при Т = 0 К), но можно измерить изменение ∆U, происходящее в том или ином процессе. Величина ∆U считается положительной, когда в рассматриваемом процессе внутренняя энергия системы возрастает.
Пусть некоторая система за счёт поглощения теплоты (Q) переходит из одного состояния в другое. В общем случае эта теплота затрачивается на изменение внутренней энергии системы ∆U = U1-U2 и на совершение работы против сил внешнего воздействия А, то есть Q = ΔU + A.
Это уравнение – математическое выражение первого закона термодинамики.
Первый закон термодинамики непосредственно связан с законом сохранения энергии, который устанавливает эквивалентность различных её форм: различные формы энергии переходят друг в друга в строго эквивалентных, всегда одинаковых соотношениях.
Из этого соотношения вытекает ряд следствий:
1) Для кругового процесса в котором ∆U = U2 – U1 = 0 , соблюдается равенство
Q= A.
2) Для изотермического процесса, в котором работа совершается против внешнего давления А= р∆V отсюда Q = ΔU + р∆V
3) Для изохорных процессов, где не происходит изменение объёма, то есть ∆V= 0 и работа А=0, Q = U2-U1 = ΔU
4) Для изобарных поцессов при Р = соnst:
Q = (U2-U1) +p(V2-V1) = (U2 + pV2) - (U1+ pV1); приращение функции U+ pV обозначим H, Q = Н2 - Н1 = ∆Н, где ∆Н – энтальпия – теплосодержание системы, но не количество теплоты в теле.
Её изменение, как и изменение внутренней энергии системы, не зависит от пути процесса, так как изменение объёма при постоянном давлении определяется только начальным и конечным состоянием системы.
Разница между внутренней энергией U и энтальпией H относительно невелика для конденсированных состояний и для веществ в кристаллическом состоянии не превышат ≈ 5%. Но разница значительна для систем, содержащих вещества в газообразном состоянии.
Изменение энтальпии может иметь положительное и отрицательное значение. Положительное значение 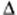 Н > 0 соответствует эндотермическому процессу т.е.процессу, идущему с поглощением теплоты, а отрицательное значение
Н > 0 соответствует эндотермическому процессу т.е.процессу, идущему с поглощением теплоты, а отрицательное значение 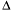 Н < 0 – экзотермическому т.е. процессу, идущему с выделением теплоты.
Н < 0 – экзотермическому т.е. процессу, идущему с выделением теплоты.
Теплота не является функцией состояния, то есть количество теплоты, выделяемой или поглощаемой системой при переходе из одного состояния в другое, зависит от пути перехода. Но для изохорных и изобарных процессов, теплота превращается в функцию состояния.
Тепловым эффектом процесса называютсумму поглощаемой теплоты и всей работы, выполняемой средой над данной системой, за вычетом работы внешнего давления. Для изохорно-изотермических процессов тепловой эффект равен изменению внутренней энергии системы ∆U = U2 – U1, а для изобарно-изотермических - изменению энтальпии ∆H = H2 – H1.
Таким образом, при постоянной температуре в изохорных и в изобарных процессах тепловой эффект не зависит от пути перехода и однозначно определяется начальным и конечным состояниями системы.
Уравнения химических реакций, в которых указаны их тепловые эффекты и агрегатные состояния компонентов называются термохимическими.От агрегатных состояний веществ зависит состояние системы в целом и в термохимических уравнениях с помощью буквенных индексов (тв.), (кр.), (ж.), (г.) обозначается твердое, кристаллическое, жидкое, газообразное состояние веществ.
В термохимических уравнениях допускаются дробные коэффициенты, так как тепловой эффект рассчитывается на 1 моль образовавшегося вещества. Например, для химической реакции
Н2 + Сl2 = 2НСl
термохимическое уравнение записывается так
1/2Н2(г) + 1/2Сl2(г) = НСl(г) + 92,3 кДж или
1/2Н2(г) + 1/2Сl2(г) = НСl(г); ∆Н = - 92,3 кДж.
Данный процесс экзотермичен, так как количество энергии, выделившейся при образовании связи H–Cl превышает расход энергии, затрачиваемый на разрыв связей
Н-Н и Cl-Cl.
Сравнение тепловых эффектов различных процессов проводят при одинаковых, стандартных условиях:температуре 298 К (25 °С) и давлении Р = 101 325 Па
(760 мм. рт. ст. = 1 атм.). Определенные для веществ в стандартном состоянии стандартные энтальпии и другие стандартные термодинамические величины обозначают верхним индексом (°), нижним индексом указывают температуру, при которой они определены: ∆Hо298, ∆Uо298 (определены при 298 К) или ∆Но1000, ∆U°1000 (определены при 1000 К). Такое единообразие делает расчёты строгими.
Стандартная энтальпия образования вещества ∆Но298 - это изменение энтальпии в процессе образования данного вещества в стандартном состоянии из термодинамически устойчивых форм простых веществ, также находящихся в стандартных состояниях.
Для многих веществ стандартные энтальпии образования известны и сведены в таблицы (приложение 6). Стандартные значения энтальпии простых веществ, если их модификации устойчивы при стандартных условиях, равны нулю. Например, ∆Hо298 (H2(г)) = 0 .
Если стандартная энтальпия образования отрицательна, соединение более устойчиво, чем простые вещества, из которых оно образовалось и наоборот. В ряду однотипных соединений, чем меньше стандартная энтальпия образования соединения (∆Hо298), тем больше его термическая устойчивость относительно разложения на простые вещества. Например, в ряду ZnO → CdO → HgO более устойчивым является ZnO, так как ∆Hо298(ZnO) = -350,6 кДж/моль, ∆Hо298(CdO) = -260,0 кДж/моль, ∆Hо298(HgO) = +99,9 кДж/моль.
Обобщение экспериментальных исследований по тепловым эффектам химических реакций привело русского ученого Г. И. Гесса к открытию закона в 1840 г., носящего его имя (закон Гесса). "Тепловой эффект процесса зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода".То есть если из данных исходных веществ можно различными способами получить заданные конечные продукты, то независимо от путей получения суммарный тепловой эффект будет одним и тем же.
Закон Гесса справедлив для изохорных и изобарных процессов. Пусть идет реакция
аА + вВ = mM + nN
Продукты реакции М и N могут быть получены различными путями: 1) непосредственно реакцией, тепловой эффект которой равен ∆Н1; 2) реакциями, тепловые эффекты которых равны соответственно ∆Н2, , ∆Н3, и ∆Н4; 3) рядом реакций с тепловыми эффектами ∆Н5 , ∆Н6 , ∆Н7 и ∆Н8. Эти тепловые эффекты, согласно закону Гесса, связаны между собой соотношением ∆Н1 = ∆Н2 + ∆Н3 + ∆Н4 = ∆Н5 + ∆Н6 + ∆Н7 + ∆Н8
Закон Гесса широко применяется при различных термохимических расчетах; дает возможность вычислить тепловые эффекты процессов с отсутствующими экспериментальными данными или в процессах, для которых тепловые эффекты не могут быть измерены, или если процессы еще не осуществились. Если известны энтальпии образования всех веществ, участвующих в реакции, то можно рассчитать тепловой эффект любой реакции.

Так, образование СО2 из простых веществ может происходить двумя путями. Прямой путь – непосредственное сгорание графита до СО2
С(графит) + О2(г) → СО2(г); ∆Н1о = -393,5 кДж.
Косвенный путь – суммарный процесс образования и окисления СО
С(графит) + ½ О2(г) → СО(г); ∆Н2о = -110,5 кДж.
СО(г) + ½ О2(г) → СО2(г); ∆Н3о = -283,0 кДж.
С(графит) + О2(г) → СО2(г)
Рассмотренные превращения отражает схема
∆Н1о
начальное состояние С(графит) + О2(г) -------→ СО2(г) конечное состояние
∆Н2о \ / ∆Н3о
СО(г) + ½ О2(г)
При сложение ∆Н2о + ∆Н3о = -110,5 + (-283,0) = -393,5 кДж, что соответствует значению ∆Н3о = -393,5 кДж.
Из закона Гесса, который является одним из следствий закона сохранения энергии, вытекает ряд выводов. Наиболее важны из них два:
1) тепловой эффект химической реакции при р = соnst равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом коэффициентов перед формулами веществ в уравнении; то есть для реакции
aA + bB = mM + nN
∆Hох.р. = (m∆Нообр. М + n∆Hoобр. N) – (a∆Hoобр.А + b∆Hoобр. В)
2) тепловой эффект реакции горения равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов:
∆Hох.р. = (a∆Нообр.A + b∆Hoобр. B) – (m∆Hoобр.M + n∆Hoобр. N)
Первое следствие имеет общее значение, второе важно для органических соединений. Первый закон термодинамики имеет универсальный характер, он применим и для одной молекулы, и для большого числа молекул; но он не указывает на характер, возможности и направление процессов, при которых могут или будут происходить превращения энергии.
Читайте також:
- Б.Рассел, підкреслюючи, що людина є частиною природи, уважав, що людські «думки й рухи слідують тим же законам, що й рух зірок і атомів». Яку точку зору відстоював Рассел?
- Для первого электрода
- Семинар 1. Первое начало термодинамики.
- Семинар 1. Первое начало термодинамики.
- Семинар 6. Фазовые переходы первого рода.
- Семинар 6. Фазовые переходы первого рода.
- Умови трудового договору не повинні мати положень, які протирічать законам та іншим нормативно-правовим актам з охорони праці.
- Уравнение динамики вращательного движения твердого тела
- Уравнение неразрывности (сплошности) для стационарного движения сжимаемой жидкости.
- Уравнение Стокса изотермического движения ньютоновской
- Уравнение электронного усилителя
| <== попередня сторінка | | | наступна сторінка ==> |
| Сутність аналізу | | | Література |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |