
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Послідовність виконання роботи
1. Ознайомитися з інтерфейсом комп’ютерної програми „Робота газу“.
2. На інтерфейсі програми вибрати лінійну залежність p(V).
3. Перемістити мишкою точку графіка, що відповідає стану газу 1 у точку з координатами (p;V), згідно вашого варіанту (таблиця 31.1).
4. Перемістити мишкою точку графіка, що відповідає стану газу 2 так, щоб утворена пряма набула вигляду p(V)-діаграми для ізобарного процесу.
5. Записати в таблицю значення тиску, об’єму і температури для стану 1 і для стану 2 термодинамічної системи.
6. За формулами (31.1), (31.8), (31.10) визначити внутрішню енергію, роботу та кількість теплоти, яку отримав газ.
7. Порівняти розраховані значення внутрішньої енергії, роботи і теплоти з такими ж значеннями, отриманими за допомогою робочої програми.
8. Перевірити виконання першого закону термодинаміки.
9. Повторити пункти 3-8 для ізотермічного і адіабатного процесів, використовуючи експоненціальну залежність p(V).
Примітка: для ізотермічного і адіабатного процесів знайдіть роботу, порахувавши площу криволінійної трапеції, попередньо розбивши її на n елементарних трапецій.
Площу трапеції, що відповідає елементарній роботі δA можна порахувати за формулою
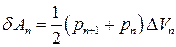 , (31.14)
, (31.14)
тоді робота виконана газом, що відповідає площі криволінійної трапеції
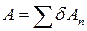 . (31.15)
. (31.15)
Таблиця 31.1 – Варіанти завдань
| Номер варіанту | |||||||
| p, кПа | |||||||
| V, дм3 | |||||||
| Номер варіанту | |||||||
| p, кПа | |||||||
| V, дм3 |
Контрольні запитання
1. Які системи називають термодинамічними, ізольованими?
2. Які процеси називають термодинамічними, квазістатичними?
3. Дайте означення внутрішньої енергії тіла.
4. Яким чином можна змінити внутрішню енергію тіла?
5. Розкрийте фізичний зміст роботи в термодинаміці.
6. Що таке кількість теплоти?
7. Сформулюйте перший закон термодинаміки.
8. Запишіть формули роботи і кількості теплоти для ізопроцесів.
9. Запишіть рівняння Майєра.
10. Чому дорівнює показник адіабати?
Читайте також:
- II. Вимоги безпеки перед початком роботи
- II. Вимоги безпеки праці перед початком роботи
- III. Виконання бюджету
- III. Вимоги безпеки під час виконання роботи
- III. Вимоги безпеки під час виконання роботи
- III. Вимоги безпеки під час виконання роботи
- Internet. - це мережа з комутацією пакетів, і її можна порівняти з організацією роботи звичайної пошти.
- IV. Вимоги безпеки під час роботи на навчально-дослідній ділянці
- IV. Вимоги безпеки після закінчення роботи
- IV. Вимоги безпеки після закінчення роботи
- IІІ. Послідовність виконання курсової роботи
- S Визначення оптимального темпу роботи з урахуванням динаміки наростання втоми.
| <== попередня сторінка | | | наступна сторінка ==> |
| Теоретичні відомості | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |