
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Амінокислоти.
Амінокислоти – похідні органічних кислот аліфатичного або ароматичного ряду і містять аміно- та карбоксильну групи (звідки походить й назва). Загальна формула:
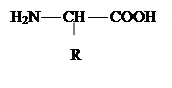 |
Вони відрізняються між собою природою радикала (R). До складу більшості білків входять 20 амінокислот, 10 з яких найбільш розповсюджені.
Класифікація амінокислот: аліфатичні (моноаміномонокарбонові, моноамінодикарбонові, діаміномонокарбонові, діамінодикарбонові) та циклічні (ароматичні, гетероциклічні):
1) моноаміномонокарбонові:
гліцин аланін cерин треонін
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N — CH — COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N — CH — COOH
½ ½ ½ ½
H CH3 CH2 — OH CH ¾ OH
½
 CH3
CH3
валін лейцин ізолейцин цистеїн
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
½ ½ ½ ½
CH ¾ СH3 CH2 CH ¾ СH3 CH2 ¾ SH
½ ½ ½
CH3 CH2 ¾ СH3 CH2 ¾ СH3
½
 CH3
CH3
метіонін
 H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH
½
CH2
½
CH2 ¾ S ¾ CH3
2) моноамінодикарбонові:
аспарагінова кислота (аспартат) глутамінова кислотата (глутамат)
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
½ ½
CH2 (CH2)2
½ ½
COOH COOH
3) діаміномонокарбонові:
лізин аргінін
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
½ ½
(CH2)4 (CH2)3
½ ½
NH2 HN
 ½
½
С = NH
½
NH2
4) діамінодикарбонові:
цистин
 H2N ¾ CH ¾ COOH NH2
H2N ¾ CH ¾ COOH NH2
½ ½
CH2 ¾ S ¾ S ¾ CH2 ¾ CH
½
COOH
5) ароматичні:
фенілаланін тирозин
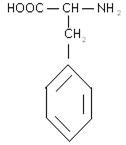
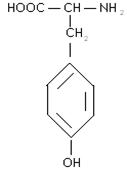
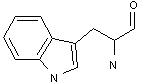
6) гетероциклічні:
триптофан гістидин пролін оксипролін
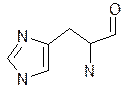
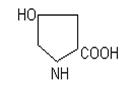

Фізико-хімічні властивості.Це безбарвні кристалічні речовини, які добре розчиняються у воді, різні на смак; tплавлення>200 оС, деякі при нагріванні розкладаються (фенілаланін, тирозин, цистеїн і інш.). Всі містять аміногрупу біля a-вуглецевого атому, тому є a-амінокислотами. Можливість оптичної ізомерії є наслідком наявності 4 різних замісників біля вуглецевого атому:
R1
½
R4 ¾ C ¾ R2
½
R3
Амінокислоти є оптично-активними сполуками, це проявляється у тому, що вони обертають кут плоскополяризованого світла вліво або вправо. В залежності від просторової конфігурації замісників біля a-вуглецевого атому вони поділяються на Д та L-ізомери. Це стереоізомерія, для якої є „ключ” – гліцериновий альдегід:
COH COH
½ ½
H ¾ C* ¾ OH ОН ¾ C* ¾ H
½ ½
CH2OH CH2OH
D-ізомер L-ізомер
У відповідності до цього:
СOOH СOOH
½ ½
H ¾ C ¾ NH2 H2N ¾ C ¾ H
½ ½
R (D-амінокислота) R (L-амінокислота)
В білках рослинного і тваринного походження переважають амінокислоти L-ряду.
Амінокислоти – амфотерні сполуки, які містять 2 функціональні групи: карбоксильну і амінну. Згідно хімічної теорії: кислоти – донори Н+, луги – акцептори Н+. Тому у водних розчинах амінокислот утворюється нейтральна сполука – внутрішня сіль амінокислоти (це стосується моноаміномонокарбонових кислот), внаслідок внутрішньомолекулярної взаємодії:
H2N ¾ CH ¾ COOH H3N+ ¾ CH ¾ COO-
½ « ½
R R (цвіттеріон = біполярний іон)
В водних розчинах амінокислоти виявляють властивості амфотерних електролітів (амфолітів):
H3N+ ¾ CH ¾ COO- H3N+ ¾ CH ¾ COOH
½ + H+ « ½
R R
H3N+ ¾ CH ¾ COO- H2N ¾ CH ¾ COO-
½ + OH- « ½ + Н2О
R R
Значення рН середовища, при якому сумарний заряд амінокислоти становить „0” – ізоелектрична точка. В цій точці кислота електронейтральна і не рухається в електричному полі. Вона залежить від кількості груп здатних до іонізації. Слід зазначити, що ступінь іонізації карбоксильних груп дещо вище, ніж аміногруп, тому для моноаміномокарбонових кислот ізоелектрична точка спостерігається при рН близьких до 5-6.
Окремі хімічні реакції, методи визначення і розділення.Амінокислоти здатні реагувати по обом функціональним групам, а також мають і специфічні властивості:
- взаємодія аміногрупи з азотистою кислотою (на цій реакції грунтується метод кількісного визначення амінокислот по Д.Ван-Сляйку):
R ¾ CH ¾ COOH R ¾ CH ¾ COOH
½ + HNO2 ® ½ + N2 + H2O
H2N OH (оксикислота)
- реакція аміногрупи з формальдегідом (лежить в основі методу формольного титрування або кількісного визначення амінокислот по С.П.Сьоренсену):
HOOC ¾ CH ¾ NH2 HOOC ¾ CH ¾ N = CH2
½ + HCOH ® ½ + H2O
R R (метиленове похідне)
- взаємодія зі спиртами з утворенням складних ефірів (використовується для розділення і визначення амінокислот шляхом фракційної перегонки їх ефірів в вакуумі):
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOC2H5
½ + С2H5 OH ® ½ + H2O
R R (складний ефір)
- реакція з нінгідрином; при нагріванні a-амінокислот з нінгідрином вони зазнають окисного дезамінування і декарбоксилювання, а нінгідрин відновлюється і формує димери, внаслідок чого утворюється сполука синьо-фіолетового кольору (рН>5), відповідний амінокислоті альдегід та СО2; кольор утворюваних сполук залежить від рН та природи амінокислоти, в присутності органічних розчинників утворюються сполуки, які мають червоний, жовтий, голубий кольор тощо (реакція використовується для лабораторного визначення амінокислот та в автоматичних аналізаторах).
Велике значення в багатьох галузях харчової промисловості має взаємодія амінокислот з відновлюючими цукрами (їх карбонільною групою). При цьому розкладається як амінокислота, так і цукор. З амінокислоти утворюється відповідний альдегід, аміак і СО2, а з цукру – фурфурол або оксиметилфурфурол:
H2N ¾ CH ¾ COOH CH3 ¾ CH ¾ CH2 ¾ COH
½ + цукор (ксилоза) ® ½ + NH3 + CO2 + фурфурол
СH2 CH3
½ (ізовалеріановий альдегід)
CH ¾ CH3
½
CH3
Альдегіди мають специфічний запах, від якого великою мірою залежить аромат харчових продуктів. Фурфурол (оксиметилфурфурол) утворює з амінокислотами темнозабарвлені продукти – меланоїдини. Ці процеси відбуваються при зберіганні, сушці плодів і овочів, термічній обробці м’яса, виготовленні кондитерських виробів.
Добування та розділення.Амінокислоти добувають гідролізом білків (лужний, кислотний, ферментативний), хімічним синтезом та мікробіологічними методами. Зокрема, внаслідок кислотного гідролізу утворюється суміш амінокислот, які можна розділити кількома методами:
Хроматографічним (іонообмінна хроматографія на смолах, тонкошарова на папері і інш.). В основі методу розділення лежать кислотно-основні властивості амінокислот (заряд) та їх сорбційна здатність. Наприклад, при тонкошаровій хроматографії амінокислоти в залежності від їх заряду і сорбційної здатності з різною швидкістю рухаються разом з розчинником по хроматографічному паперу від лінії старту.
Електрофорез. В основі методу також лежать кислотно-основні властивості амінокислот (заряд при різному значенні рН). При електрофорезі на папері наносять на змочений буфером фільтрувальний папер пляму суміші амінокислот, розділення відбувається у постійному електричному струмі з високою напругою. Амінокислоти, які при даному рН електронейтральні, залишаються на своєму місці, інші, в залежності від заряду, мігрують до катоду/аноду.
В сучасній промисловості для добування окремих амінокислот широко застосовують мікробіологічний метод. Наприклад, лізин добувають, використовуючі штами Micrococcus, як поживне середовище використовують малясу, кукурудзяний екстракт, білкові гідролізати, як джерело азоту – солі амонію і сечовину. Триптофан добувають за участю мутантів E.coli.
Незамінні амінокислоти.В організмі не синтезуються, обов’язково повинні до нього надходити з їжею. Це 8 амінокислот: валін, лейцин, ізолейцин, треонін, метіонін, лізин, фенілаланін, триптофан. Напівзамінні амінокислоти утворюються в недостатній кількості, а замінні повністю синтезуються з інших сполук. Метіонін, лізин і триптофан входить до складу кормових концентратів, які підвищують якість відгодівлі сільськогосподарських тварин. Вони поліпшують засвоєння білку, збільшують нагромадження азоту, стимулюють ріст і розвиток молодих тварин. Метіонін використовують при захворюваннях печінки, недокрів’ї, опіках. Триптофан – для лікування пелагри, психічних хвороб.
Білки.
Будова білків. Рівні структури та природа.Цю проблему вивчали Данилевський О., Фішер Е. Білки – одна з найскладніших і високоорганізованих структур в живій природі. Існує кілька рівнів структурної організації білку.
Первинна структура. Це послідовність залишків амінокислот в поліпептидному ланцюгу. Є специфічною і генетично детермінованою. Подібність будови первинних структур різних білків називається гомологією і може свідчити про еволюційну спорідненість. Амінокислоти поєднані між собою пептидним зв’язком (це варіант амідного зв’язку):
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ NH2 H2N ¾ CH ¾ CONH ¾ CH ¾ COOH
½ + ½ ® ½ ½ + H2O
R1 R2 R1 R2
(дипептид)
А, наприклад, назва трипептиду – аланіл-валіл-цистеїн. В науковій літературі амінокислоти позначають латинськими літерами.
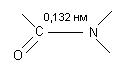
будова пептидного зв’язку
Первинна структура є основою всіх інших. За з’ясування первинної структури інсуліну Сенгером Ф. у 1962 році присуджена Нобелівська премія.
Вторинна структура. Це просторова конфігурація поліпептидного ланцюга. Запропанована на основі рентгеноструктурного аналізу Полінгом Л. та Корі Р. Це правозакручена a-спіраль, до якої входять амінокислотити L-ряду. ЇЇ параметри: на одни виток спіралі припадає 3,6 залишка амінокислот, відстань між витками – 0,54 нм (крок спіралі):

Стабілізація спіральної структури забезпечується чисельними слабкими водневими зв’язками, які утворюються між атомами водню імінної групи одного пептидного зв’язку (має частковий позитивний заряд) та киснем карбоксильної групи іншого (несе частковий негативний заряд):
= С = Od- ··· Hd+ ¾ N =
Зазначених зв’язків дуже багато, тому в сукупності формується достатньо міцна структура.
Для білків сполучної тканини (колаген, фіброїн, кератин) в шерсті, волоссі, шкірі, шовку, сухожилках характерна інша структура - b-складчастий шар:

Відповідні білки не мають ферментативної активності. В більшості білків чергуються спіралізовані і неспіралізовані ділянки.
Третинна структура. Це певне положення спіралізованих і неспіралізованих ділянок у просторі (конформація):
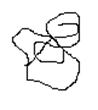
Від специфічної просторової будови залежить біологічна активність білку, в першу чергу, ферментативна. Вперше її розшифрував у 1957 році для міоглобіну Дж. Кендрю. Фактори стабілізації третинної структури:
- водневі зв’язки;
- іонні зв’язки (електростатичні зв’язки між протилежно зарядженими радикалами амінокислот);
- гідрофобні зв’язки (міжмолекулярна взаємодія між неполярними радикалами амінокислот), наприклад, такі зв’язки утворюють аланін, валін, лейцин, фенілаланін і т.д.;
- ковалентний зв’язок (міцна хімічна взаємодія за рахунок утворення спільних електронних пар; в білках – це дисульфідний зв’язок.
Наприклад, в інсуліні 3 дисульфідних зв’язка, 2 міжланцюгові і 1 внутрішньоланцюговий. Багато дисульфідних зв’язків в сполучній тканині, волоссі (на руйнуванні та відновленні дисульфідних зв’язків грунтується хімічна завивка, виготовлення шкір тощо).
Іноді має місце четвертинна структура (гемоглобін). Тоді такий білок називають олігомерним, а окремі субодиниці – протомерами. Мгемоглобіну=68000, субодиниці – 17000. Стабілізація структури досягається різними типами зв’язків. За дії фізико-хімічних факторів (сечовина, органічні розчинники, мінеральні солі, різка зміна рН) відбувається дисоціація субодиниць, при відмиванні – реасоціація.
Білки класифікують за формою третинної структури: глобулярна чи фібрилярна. Фібрилярні білки – це білки сполучної тканини, в структурі переважає b-складчастий шар, мають форму стрижня, нитки. Більшість ферментів – глобулярні білки, причому порушення третинної структури призводить до втрати ферментативної активності. Глобулярні білки мають форму шару, кульки, сфери. На конформацію глобули впливають рН, температура, іонна сила тощо. Молекулярна маса білків коливається від кількох тисяч до 10-100 млн.: поліпептиди ( 6 тис.), олігомери ( 50-60 тис.); інсулін – 5700, люд. альбумін – 69000, вірус тютюнової мозаїки – 2 тис. протомерів.
Методи визначення маси білків. (1) Осмометрія: визначення за осмотичним тиском розчину білку. (2) Оптичні методи: інтенсивність розсіювання світла молекулами прямо пропорційна їх числу та розмірам. (3) Аналітичні методи: у різних білках містяться певні хімічні елементи в постійній кількості, знаючи їх % вміст можна вирахувати масу. (4) Гельфільтрація: через прокалібровану білками з відомою масою і заповнену гідратованим полімерним матеріалом (сефадексом) колонку пропускають розчин білку, швидкість проходження обернено пропорційна розмірам молекул; таким методом білки можна очищати, розділяти та, по швидкості проходження, порівнюючи зі стандартом, визначати масу. (5) Седиментаційний аналіз: з використанням ультрацентрифуг.
Фізико-хімічні властивості.Білки – амфотерні поліелектроліти. Заряд макромолекули зумовлюється наявністю заряджених амінокислот: „-„ аспарагінова та глутамінова кислоти, „+” лізин та аргінін. В білках переважає „-„, втім, лужний характер мають протаміни і гістони. Ізоелектрична точка білку – значення рН, при якому молекула електронейтральна. Наприклад, за додавання Н+ (закислення середовища) до білку (1) утворюється білок (2), який є в цілому електронейтральний:
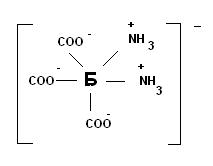

(1) (2)
Існує два фактори стабілізації білку у водних розчинах – заряд та гідратаційна вода. Тому в ізоелектричній точці за наявності водовідбираючих агентів білок випадає в осад. Гідрофільні групи на поверхні білків мають заряд і зв’язують диполі води – зв’язана вода або гідратна оболонка. В лужному середовищі білок стає аніоном і рухається в електричному полі до аноду, у кислому – катіоном і рухається до катоду. Внаслідок негативного заряду ізоелектрична точка більшості білків знаходиться при кислому рН.
Деякі реакції білків: фосфорилювання (по залишкам серину, треоніну, тирозину), ацилювання, окислення/відновлення (цистеїн), естеріфікація, взаємодія з металами (іноді метали стабілізують певну конформацію білку або можуть входити до його складу – металопротеїди). Реакційна здатність залежить від природи радикалів в амінокислотах. Хімічні модифікації змінюють біохімічну характеристику білків, в першу чергу, ферментативні властивості. Легко утворюють комплекси з ліпідами і вуглеводами (ліпопротеїди та глікопротеїди).
Розчинність білків у воді залежить від багатьох факторів – іонної сили, рН, температури. Явище, коли при додаванні невеликих кількостей нейтральних солей збільшується розчинність білку називається засолюванням (глобуліни, міозин з високими дипольними моментами), воно пояснюється тим, що невеликі кількості іонів екранують дипольні заряди на білку. При значному збільшенні концентрації нейтральної солі, тобто іонної сили розчину, відбувається випадання білків в осад – висолювання. Пояснюється конкуренцією іонів за диполі води, які формують гідратну оболонку білку. По здатності до висолювання катіони і аніони утворюють ліотропні ряди. В практиці для очищення і розділення білків використовують NaCl, KCl, (NH4)SO4. Так, глобуліни випадають в осад в напівнасичених розчинах, а альбуміни при 100% насиченні, що залежить від заряду та дипольного моменту. Зменшення гідратації білку можна досягти додаючі спирт, ацетон при низьких температурах, при цьому спостерігається зворотнє осадження, яке використовується, зокрема, для вивчення білків крові.
Денатурація – це втрата властивостей нативного білку під впливом фізико-хімічних факторів, які призводять до руйнування третинної і, частково, вторинної структури. Серед основних денатуруючих агентів: температура (вища 50-60 оС), ультразвук, іонізуюче і УФ-опромінення, сильні луги та кислоти (серед органічних сульфосаліцилова, трихлороцтова), солі важких металів. При денатурації зв’язки руйнуються, поліпептидний ланцюг розгортається, утворюється нитка, в якій хаотично формуються інші зв’язки. Тобто порушується нативна конформація білку – специфічна просторова структура. Якщо видалити денатуруючий агент, який діяв короткий час, можна спостерігати ренатурацію (зворотня денатурація). Практичне значення денатурації – переробка продуктів харчування (термічна), консервація, сушка (в цих випадках спостерігається денатурація ферментів бактерій, які псують продукт).
Колоїдні властивості білків. Білки в водних розчинах являють собою часточки розміром 0,001-0,1 ммк. Це гідрофільні колоїди (золі). Якщо до білку (желатину) додати води, то він набрякає, утворюючі гель, в якому частина води зв’язана (гідратаційна), а частина вільна. За певних умов вода відокремлюється від гелю – явище синерезису, яке є оборотнє набряканню. Переходи золь - гель мають значення в функціонуванні цитоплазми клітин, проростанні зерна, замочуванні желатину, випіканні хлібу тощо. Колоїдні розчини здатні розсіювати промені світла – конус Тіндаля.
Методи визначення білків (якісні реакції). Біуретова реакція. Це реакція на пептидний зв’язок. Сполуки, які мають 2 або більше пептидних зв’язка утворюють в лужному середовищі в присутності сульфату міді (2) комплекси, забарвлені у фіолетовий кольор. Ксантопротеїнова реакція. Ароматичні амінокислоти (фенілаланін, тирозин, триптофан) дають з азотною кислотою нітросполуки жовтого кольору внаслідок нітрування бензольного кільця. Реакція Міллона. Зумовлена наявністю в білках тирозину. Реактив Міллона – суміш нітратів і нітритів ртуті (1,2) в конц. азотній кислоті. З білком утворює білий осад, який при нагріванні стає червоним.
Методи виділення і очищення білків.Гельфільтрація (див. вище). Діаліз. Білки не проходять крізь напівпроникні перетинки в водних розчинах (целюлоза, пергамент), при цьому йде очищення від низькомолекулярних домішок. Електрофорез. Розділення за зарядом при певному рН на носії (поліакриламідний гель) в електричному струмі. Хроматографія (див. вище).
Класифікація білків.Це класифікація за фізико-хімічними властивостями.
(1) Протеїни (прості). До їх складу входять лише залишки амінокислот.
Альбуміни. Дуже добре розчинні у воді, висолюються 100% розчином сульфату амонію. Молекули еліпсовидної форми (молекулярна маса до 70 тис.). Багаті лейцином і сірковмісними амінокислотами, дуже мало гліцину. Поширені в сироватці крові. Багато їх в молоці (лактоальбуміни), яйцях (овоальбумін), злакових, бобових (легумелін). Функції в організмі: підтримання онкотичного тиску крові, забезпечення транспорту ліпідів, стероїдних гормонів, лікарських речовин.
Глобуліни. Менш гідрофільні, ніж альбуміни, із рослинних і тваринних тканин екстрагуються 10% розчинами солей, в 50% розчинах випадають в осад, молекулярна маса до 1,5 млн. Містять до 5% гліцину і меншу кількість сірковмісних амінокислот, ніж альбуміни. Особливо велика кількість знаходиться в насінні злакових, соняшнику, бобових (фазеолін квасолі, легумін гороху). В крові виділяють фракції глобулінів - a, b, g - глобуліни. a, b - глобуліни утворюють глікопротеїдні комплекси (глікопротеїд церулоплазмін забезпечує в організмі транспорт міді, b-глубулін трансферин - транспорт заліза). Антитіла за хімічною природою є g-глобулінами. Альбумін/глобуліновий коефіцієнт - показник фізіологічного стану, у здорової людини він становить1,7-2,3.
Проламіни. Розповсюджені в рослинах. Містять велику кількість проліну, зовсім не містять лізину. Екстрагуються з тканин 70% спиртом. Входять до складу насіння злаків (гліадин пшениці, зеїн кукурудзи).
Глутеліни. Розповсюджені в рослинах. В їх складі наявна велика кількість глутамінової кислоти та лізину. Погано розчинні у воді і добре у розведених лугах.
Протаміни. Містять до 70% аргеніну, мають виражений лужний характер. Добре розчинні у воді, термостабільні. В великих кількостях розповсюджені у внутрішніх органах, залозах внутрішньої секреції, молоках риб. Містяться в ядрах клітин, де утворюють нуклеопротеїдні комплекси.
Гістони. Мають лужний характер, до 40% вмісту складають діаміномонокарбонові кислоти. Розповсюджені у внутрішніх органах (печінка, нирки, селезінка). Знаходяться в ядрах клітин, де утворюють нуклеопротеїдні комплекси, з яких побудовані хромосоми. Відіграють важливу роль в регуляції функцій і структурі ДНК.
Протеїноїди. Це білки сполучної і покривної тканин. Входять до складу тваринних тканин і виконують структурну, механічну і опорну функції. Нерозчинні у воді, кислотах, лугах, розчинах солей. Слабко гідролізуються травними ферментами, тому погано засвоюються і сприяють гниттю у кишках. У структурі розповсюджений b-складчастий шар. Колаген. Основний компонент сухожилок, зв’язок, хрящів, шкіри, кісток (може становити до 25% усіх білків тварини). Містить гліцин, пролін, оксипролін, не містить сірковмісних амінокислот, має фібрилярну будову. При тривалому кип’ятінні утворює гель – желатину. Кератин. Має велику кількість сірковмісних амінокислот, в молекулі багато дисульфідних зв’язків, що зумовлює міцність та хімічну стійкість. Входить до складу шерсті, волосся, рогів, копит, сполучної тканини. При гідролізі або відновленні сульфідами дисульфідні зв’язки розриваються і підвищується розчинність, що в промисловості використовується для видалення волосяного покриву шкір тварин. При пранні шерстяних речей руйнуються водневі і іонні зв’язки, білки скорочуються, в побуті це явище отримало назву „сідання”. Еластин. Містить велику кількість гліцину, проліну, валіну. Не містить сірковмісних і ароматичних амінокислот. Формує сполучнотканинні елементи судин. Після кулінарної обробки може частково розщеплюватись травними ферментами і засвоюватись. Фіброїн – білок натурального шовку, виділяється спеціальними залозами шовкопрядів і павуків.
(2) Протеїди (складні). Складаються з простого білку і сполуки небілкової природи – простетичної групи.
Глікопротеїди. Простетичною групою є вуглеводи (олігосахариди). Нейтральні глікопротеїди (небілковою частиною є аміносахара – глюкозамін, галактозамін, гексози, сіалові кислоти). Містяться в крові, білках молока, яйцях. Багато ферментів і деякі гормони мають глікопротеїдну природу. Простетична група зв’язана з білковою міцними ковалентними зв’язками, вуглеводна частина менша за 5%. Мукопротеїди. Вуглеводна частина більша за 5%, зв’язана з білковою слабкими зв’язками. Вона включає залишки гексуронових кислот і сульфатів, що зумовлює кислий характер. Включають хондроїтинсірчану кислоту (хрящі, зв’язки, сухожилки) і гіалуронову кислоту (основна речовина сполучної тканини). Серед мукопротеїдів виділяють муцини і мукоїди. Муцини входять до складу слини, шлункового соку, захищають слизові оболонки кишкового тракту від дії травних ферментів. Мукоїди забезпечують функціонування сполучної тканини.
Ліпопротеїди. Простетична група – ліпіди. Розповсюджені в тваринних і рослинних тканинах. Їх утворення підвищує розчинність ліпідів за рахунок формування міцел: на поверхні гідрофільні білки, а всередині – гідрофобні ліпіди. Це транспортна форма ліпідів в плазмі крові. Утворюють з білками нековалентні зв’язки, білкова частина – глобуліни:
-ліпопротеїди високої густини, білок:ліпіди – 1:1, включають фосфоліпіди, холестерин;
-низької густини, 25% білку, високий вміст холестерину;
-дуже низької густини, 91% ліпідів, включають триацилгліцероли;
-хіломікрони, 1% білку, це основна транспортна форма ліпідів.
Рівень ліпопротеїдів низької густини підвищується при гіпертонії, атеросклерозі. В біологічних мембранах ліпіди становлять 30% сухої маси, особливо фосфатидилхолін.
Нуклеопротеїди. Простетична група – нуклеїнові кислоти (РНК, ДНК). Білкова частина в більшості представлена протамінами і гістонами, яка зв’язана з небілковою іонними зв’язками через фосфорну кислоту. Містяться переважно в ядрі, молоках риб. Основні функції: ріст, розвиток, біосинтез білку, передача та збереження спадкової інформації.
Хромопротеїди. Мають забарвлену простетичну групу: похідні ізоалоксазину (флавопротеїди) та порфірину (гемопротеїди). Гемоглобін. У 1968 році Перутц М. відкрив третинну структуру цього білку, за що одержав Нобелівську премію. Глобінова (білкова) частина складається з 4 субодиниць, пов’язаних електростатичними зв’язками, кожна субодиниця включає небілкову частину - гем (порфіринове кільце з Fe2+); для гемоглобіну характерне висококооперативне зв’язування 4О2. Видова різноманітність зумовлюється амінокислотним складом. В легенях високий парціальний тиск О2, тому спостерігається його зв’язування з гемоглобіном, при цьому суттєво змінюється третинна та четвертинна структури. В тканинах низький рО2, але великий рСО2, тому гемоглобін зв’язує СО2 і звільнює О2. Спорідненість гемоглобіну до СО значно вища, ніж до О2, що лежить в основі отруєння чадним газом. При серповидній анемії (спадкова хвороба) заміна в одному ланцюзі глобіну амінокислоти глутамату на валін змінює форму, розинність, транспортну здатність білку. Міоглобін. Третинна ст-ра розшифрована Кендрю Дж. у 1957 р., молекулярна маса - 17500. Молекула побудована з 1 поліпептидного ланцюга, небілкова частина представлена гемом, 70% глобінової частини спіралізовано, неспіралізовані ділянки містять пролін, який перешкоджає спіралізації. Міоглобін - резерв О2 в спокої в м’язах, який використовується при м’язовому навантаженні. Міоглобін дає червоне забарвлення м’ясу. Чим більше навантаження на м’яз, тим більш червоне м’ясо (грудні м’язи птахів, м’язи ніг парнокопитних). При з’єднанні з СО утворюється карбоксиміоглобін вишнево-червоного кольору, а з NO - нітрозоміоглобін червоного кольору. Ці процеси мають місце при солінні і коптінні м’яса. У членистоногих і молюсків замість гемоглобіну присутній блакитний гемоціан (мідьвмісний пігмент).
Фосфопротеїди. Це білки, фосфорильовані по спиртовим групам серину, треоніну, тирозину. Тобто простетична група – залишки ортофосфорної кислоти, зв’язані з білковою частиною складноефірним зв’язком. Важливу роль відіграють в обмінних процесах, рості, розвитку. Часто використовуються для живлення ембріонів (багато в яйці, молоці), де виступають донорами лабільних фосфорних груп. Казеїн – найпоширеніший фосфопротеїд молока, молекулярна маса сягає 100 тис., не розчиняється у воді, але розчиняється у сольових розчинах, ізоелектрична точка спостерігається при рН=4,8. Казеїн містить всі незамінні амінокислоти, виступає важливим джерелом неорганічного фосфату для синтезу АТФ, креатинфосфату, формування кісткової тканини. Тому є необхідним для повноцінного раціону. Біля 30% яєчного жовтку складають фосфопротеїди вітелін та фосфовітин.
Металопротеїди. Простетичною групою є метал, який ковалентно зв’язаний з білком. До цього класу відносяться чисельні ферменти: супероксиддисмутаза (мідь, цинк), карбоксипептидаза (цинк); транспортні білки з резервною функцією (церулоплазмін, феритин).
Поліпептиди. Найважливішим трипептидом є глутатіон. Він складається із залишків глутамінової кислоти, цистеїну та гліцину; містить вільну –SH групу. Є складовою частиною багатьох ферментів (тканинні катепсини – протеолітичні ферменти), захищає сульфгідрильні групи білків від окислення та інактивації. Є потужним антиоксидантом – захищає організм від реакційноздатних вільних радикалів (в тому числі продуктів окислення ліпідів киснем). При нагріванні рослинної/тваринної сировини в умовах дефіциту кисню кількість відновленого глутатіону зростає.
Білки м’язів. Біохімічні основи скорочення.М’язова тканина становить біля 40% маси тварин і є основою для виробництва м’ясних продуктів. В організмі вона викионує механічну – рухову функцію. Поділяється на скелетну, гладеньку і сецеву мускулатуру. Для промисловості найбільше значення має скелетна мускулатура. Ця тканина складається з багатоядерних м’язових клітин (діаметр до 100 мкм, довжина до 12 см), так званого м’язового волокна. М’язове волокно вкрите плазматичною мембраною – сарколемою, цитоплазма має назву міоплазма або саркоплазма. Основну частину м’язового волокна займають міофібрили – ниткоподібні білки скоротливого апарату. Всі структури м’язового волокна мають білкову природу і технологічне значення. До 50% білків м’язової тканини складають міофібрили, 40% - білки саркоплазми. Білки міофібрил: актин, міозин, тропоніни і деякі інші., вони відповідають за скорочення м’язів. Для виділення міозину його екстрагують із гомогенатів м’язів 0,6 М хлоридом калію у фосфатному буфері при рН=6,5 за низької температури. Його молекулярна маса близька до 500 тис., добре зв’язує Са2+ та АТР, на 30% складається з моноамінодикарбонових кислот, тому має кислий характер (ізоелектрична точка при рН=5,4), до 1,5% складають залишки цистеїну. Молекула міозину побудована з 4 поліпептидних ланцюгів: 2 великих, які при скороченні взаємодіють з актином та 2 малих – регуляторних (регуляція шляхом фосфорилювання). В „зібраному” стані міозин має фібрилярний „хвіст” та глобулярну „голівку”. Актин складає до 15% білків м’язів. Існує у глобулярній та фібрилярній формах, молекулярна маса глобулярної форми 47 тис. В присутності іонів калію і магнію актин полімеризується (глобули складаються в фібрили). При взаємодії міозину з актином значно посилюється здатність міозину розщеплювати АТФ, утворюється актоміозиновий комплекс. Ковзання ниток актину та міозину за рахунок взаємодії голівок міозина з актином лежить в основі скорочення. Енергозабезпечення процесу досягається за рухунок гліколізу і, частково, дихання, рівень АТФ в працюючому м’язі підтримується за рахунок креатинфосфату. Тропоніни в незбудженому скелетному м’язі блокують актин-міозинову взаємодію, це блокування знімається при зв’язуванні з тропоніном Са2+, тому іони Са є найважливішим регулятором скорочення. Білки саркоплазми. Сюди відносяться міоглобін, міоген, глобулін Х, міоальбумін. Міогени складають біля 20% білків м’яса, за фізико-хімічними властивостями близькі до альбумінів, добре розчиняються у воді, висолюються насиченими розчинами сульфату амонію. Це ферменти, які проявляють дегідрогеназну, альдолазну, інвертазну і інш. активності (багато ферментів гліколітичного обмін вуглеводів). Глобулін Х – псевдоглобуліни, розчиняються при низьких концентраціях солей, це також білки-ферменти. Міольбумін відноситься до альбумінів, добре розчиняється у воді і висолюється концентрованими розчинами сульфату амонію. Білки строми. Це сукупність сполучнотканинних елементів, які розташовані над сарколемою, і, звичайно, входять до складу м’яса. До них належать колаген, еластин, ретикулін; багато глікопротеїдів – муцини та мукоїди. До білків м’яса належать також нуклеопротеїди, але вони не мають значної харчової цінності, також різноманітні білки-ферменти. В білках м’яса міститься лізин, метіонін, триптофан, але останні 2 амінокислоти навіть у м’ясі присутні в обмеженій кількості.
Білки крові. Згортання крові. Роль антикоагулянтів в промисловості.Кров виконує ряд важливих функцій – живільна, дихальна, регуляторна, захисна, підтримує водну рівновагу та регулює температуру тіла. Складається з плазми та форменних елементів (еритроцити, лейкоцити, тромбоцити). Плазма крові без білку фібриногену називається сироваткою. Кров має слабколужну реакцію. Містить білки (альбуміни, глобуліни), небілкові азотисті речовини (креатин, вільні амінокислоти, сечовину, сечову кислоту тощо), вуглеводи (глюкоза, фруктоза, галактоза, маноза), ліпіди (вільні та ліпопротеїди), деякі (про-) вітаміни (каротин, аскорбінова кислота) і т.д. Кількість крові становить до 10% маси тіла. З крові забитих тварин виготовляють ковбаси, сальтисони, деякі консерви; використовують в медицині (кровозамінники, імунні сироватки, гематоген, тромбін і інш.). В процесі виробництва негативне значення має зсідання крові, для запобігання цього процесу використовують стабілізацію крові – вилучення форменних елементів, фібрину, додавання антикоагулянтів (цитрат, гепарин, синтетичні сполуки тощо). При переробці крові необхідно також запобігати розриву еритроцитів, так званого гемолізу. Механізм зсідання крові. При розриві кровоносних судин відбувається взаємодія крові з О2 повітря, руйнуються тромбоцити. В присутності Са2+ та спеціального ферменту з протеолітичною активністю протромбін перетворюється в тромбін. Тромбін є також протеолітичним ферментом, який перетворює розчинний білок плазми фібриноген в нерозчинний фібрин. Останній полімеризується, утворюючі сітку, в якій застрівають форменні елементи крові – формується „згусток”. Послідуюче виділення плазми з фібринового згустку одержало назву ретракція згустку. Існує велика група таких званих факторів згортання крові, взагалі процес утворення згустку дуже складний ферментативний процес, який включає активацію зазначених факторів згортання. Антикоагулянти можуть зв’язувати Са2+ - цитрат, сульфатований кислий полісахарид гепарин інгібує активацію факторів згортання крові.
Запитання і вправи для самоконтролю.
1. Дайте характеристику амінокислот, які входять до складу білків.
2. На основі яких принципів класифікують амінокислоти?
3. Охарактеризуйте фізико-хімічні властивості амінокислот.
4. Назвіть основні методи визначення і розділення амінокислот.
5. Охарактеризуйте і напишіть формули незамінних амінокислот.
6. Наведіть приклади використання амінокислот у сільському господарстві і медицині.
7. Яке значення для харчової промисловості має утворення меланоїдинів?
8. Назвіть рівні структури білка і охарактеризуйте їх.
9. Дайте характеристику типів зв’язків, які лежать в основі первинної, вторинної і третинної структури білків.
10. Охарактеризуйте a-спіраль і b-структури білків.
11. Що таке глобулярні і фібрилярні білки?
12. Охарактеризуйте фізико-хімічні властивості білків. Які існують способи визначення молекулярної маси білків.
13. Що таке явище денатурації і яке воно має значення в харчових технологіях?
14. Назвіть основні якісні реакції на амінокислоти і білки.
15. Які ви знаєте методи виділення і очищення білків?
16. Охарактеризуйте сучасну класифікацію білків.
17. Які білки відносяться до протеїнів?
18. Які білки відносяться до класу протеїдів?
19. Яке значення протеїноїдів в харчових технологіях?
20. Охарактеризуйте структуру і значення міоглобіну та гемоглобіну.
21. Назвіть відомі вам поліпептиди.
22. Охарактеризуйте білкі м’язів і назвіть основні етапи м’язового скорочення.
23. Що таке згортання крові і яке воно має значення в харчових технологіях?
Список рекомендованої літератури:[1, с. 6 – 58; 2, с. 21 – 52; 3, с. 78 – 102; 6, с. 326-349, 366-372, 384-390].
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Функції білків. | | | Нуклеїнові кислоти |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |