
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тверді розчини
У твердих розчинах (як і в рідких) атоми домішок розташовуються невпорядковано, незакономірно. У макрооб’ємах тверді розчини є однорідними системами, а в мікрооб’ємах, розміри яких порівнянні з міжатомними відстанями, в силу неупорядкованого розподілу домішок, вони неоднорідні тобто існують скупчення атомів домішок ,відмінні по хімічному складу - флуктуації. У твердих розчинах у ролі розчинника виступають кристалічні ґрати одного з компонентів атоми іншого компонента (домішки). Оскільки, домішки ,спотворюючи кристалічні ґрати, не приводять до зміни її будови (типу упакування елементарного осередку), то незалежно від числа компонентів тверді розчини є однофазними системами. Мікроструктура твердого розчину під мікроскопом буде мати вид ( рис. 4.10 ).
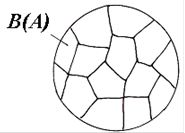 Рис. 4.10 Схематичне зображення мікроструктури твердого розчину
Рис. 4.10 Схематичне зображення мікроструктури твердого розчину
Характерні риси твердого розчину: компонент , що знаходиться в більшості, має назву розчинника, інші компоненти – домішками. Твердий розчин компонента А в компоненті В позначається в такий спосіб : В ( А ) – де компонент В є розчинником , а компонент А є домішкою. Співвідношення компонентів у твердих розчинах довільне. Від механічної суміші тверді розчини відрізняються тим, що мають один тип ґрат, а від хімічної сполуки – довільністю складу. Існують наступні види твердих розчинів:
1. Тверді розчини впровадження.
2. Тверді розчини заміщення.
3. Тверді розчини на основі хімічної сполуки.
4. Тверді розчини вирахування
5. Упорядковані тверді розчини.
Тверді розчини впровадження.
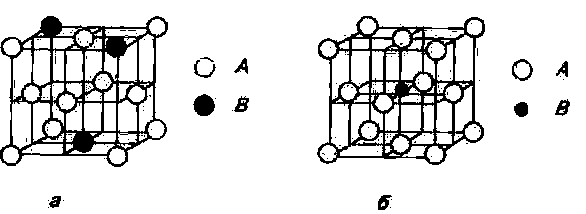
У таких розчинах атоми домішок знаходяться в між вузлами кристалічних ґрат (рис. 4.11, а). Тверді розчини впровадження утворюються домішками елементів, що мають невеликий розмір атомів. Оскільки розмір пор завжди менший розмірів атомів домішок, те їхнє впровадження завжди викликає значні пружні напруження кристалічних ґрат і її спотворення. Причому, спотворення пропорційні концентрації домішок і зі збільшенням їхньої концентрації термодинамічна стійкість системи знижується. У таких випадках однофазний стан системи стає не стійким тобто настає пересичення розчину, що приводить до виділення з нього фази збагаченої атомами домішок.
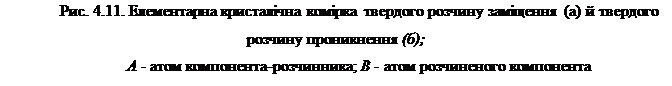 Це можуть бути кристали чистого компонента або хімічної сполуки, або іншої фази. У випадку, коли запас вільної енергії підвищується настільки, що більш вигідним є існування двох фаз, має місце обмежена розчинність. Друга фаза може виділятися в іншому агрегатному стані.
Це можуть бути кристали чистого компонента або хімічної сполуки, або іншої фази. У випадку, коли запас вільної енергії підвищується настільки, що більш вигідним є існування двох фаз, має місце обмежена розчинність. Друга фаза може виділятися в іншому агрегатному стані.
Тверді розчини заміщення
У твердих розчинах заміщення атоми домішок знаходяться у вузлах кристалічних ґрат металу розчинника. Атоми домішок можуть бути більшими чи меншими від атомів розчинника і , знаходячись у позиціях заміщення (рис. 4.11,б), викликають пружні локальні перекручування кристалічних ґрат, підвищуючи запас вільної енергії системи. Однак , і цьому випадку, темпи наростання запасу вільної енергії з підвищенням концентрації домішок менше, ніж у твердих розчинах упровадження, а в деяких випадках, узагалі, насичення не досягається, тобто має місце необмежена розчинність компонентів у твердому стані. У цьому випадку, компоненти здатні утворювати необмежений ряд твердих розчинів ( від чистого компонента А до чистого компонента В).
Умовами необмеженої розчинності компонентів одне в одному є:
- невелика різниця в розмірах компонентів (не більш ніж в 10 разів);
- ізоморфізм кристалічних ґрат тобто однаковий тип упакування;
- близька будова валентних атомних рівнів компонентів.
У деяких випадках навіть за виконання перелічених умов необмежені тверді розчини не формуються.
Тверді розчини віднімання.
Тверді розчини віднімання утворюються на базі упорядкованих твердих розчинів. При певних співвідношеннях компонентів замість атомів домішок у кристалічній гратці перебувають вакансії.
Упорядковані тверді розчини.
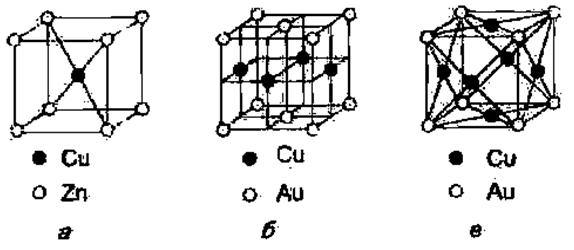
Окремі тверді розчини заміщення при повільному охолодженні при певнім кількісному співвідношенні компонентів утворюють упорядковані тверді розчини. Процес упорядкування був уперше виявлений Н.С.Курнаковим в 1914 році. При вивченні електричного опору сплавів міді й золота була відзначена зміна їхніх властивостей без видимої зміни мікроструктури.
Як відомо, у звичайних твердих розчинах атоми розчиненого елемента розподіляються в гратці розчинника невпорядковано. Однак в упорядкованих твердих розчинах , що утворюються за певних умов охолодження, атоми займають чітко визначені положення у вузлах просторової кристалічної ґратки ( рис.4.12). Умовою повної впорядкованості атомів компонентів є співвідношення між їх кількістю, що визначається цілими числами, як, наприклад, 1:1, 1:2, 1:3 і т.д. До сплавів із упорядкованим розташуванням атомів можна умовно віднести хімічні сполуки, зокрема СuZn (рис. 4.12, а), СuАu (рис.4.12, б), СuзАu (рис. 4.12, в). Коректніше впорядковані тверді розчини слід розглядати як проміжні структури між твердими розчинами й хімічними сполуками.
Коли відхилення від поданих вище співвідношень незначні, маємо лише часткову впорядкованість. Під час нагрівання вона поступово зменшується і навіть зовсім зникає.
Виникнення і зникнення впорядкованості атомів супроводжується зміною властивостей сплаву. Впорядковані тверді розчини порівняно з невпорядкованими характеризуються підвищеними твердістю, міцністю й електропровідністю, проте зниженою пластичністю.
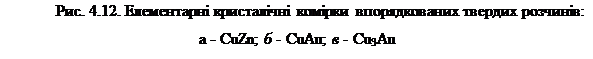
Тверді розчини на основі хімічної сполуки.
Здатність до утворення твердих розчинів властива не тільки чистим елементам , але й хімічним сполукам, у випадку , якщо вони не піддаються дисоціації. У цих випадках зберігається кристалічна гратка хімічної сполуки. Розчиненими можуть бути або атоми одного з компонентів хімічної сполуки , якщо вони в надлишку, або атоми третього елемента, що не входить у хімічну сполуку.
Для твердого розчину на базі хімічної сполуки, що розчиняє в собі сторонні атоми, прийнята спеціальна система позначення. Наприклад, борид заліза, що має формулу Fe4В2 , здатний розчиняти хром і вуглець. Хром заміняє атоми заліза у вузлах кристалічної гратки, а вуглець заміняє атоми бора, перебуваючи в позиціях впровадження. Твердий розчин на базі хімічної сполуки буде мати наступне позначення – ( Fe , Cr ) 4 (B , C )2.
4.6 Умови фазових перетворень.
Умовами необхідними і достатніми для фазових переходів є:
1. Наявність термодинамічного стимулу , під яким розуміють здатність системи знижувати запас вільної енергії (G ). Будь-яка система знаходиться в стані рівноваги ,маючи мінімальний запас вільної енергії.
2. Наявність достатньої дифузійної рухливості – кінетичний фактор.
 На рис. 4.13. показана зміна вільної енергії системи в залежності від зміни температури при кристалізації. Тр- температура рівноваги, тобто при цій температурі вільна енергія рідкої фази дорівнює вільної енергії кристалічної фази.
На рис. 4.13. показана зміна вільної енергії системи в залежності від зміни температури при кристалізації. Тр- температура рівноваги, тобто при цій температурі вільна енергія рідкої фази дорівнює вільної енергії кристалічної фази.
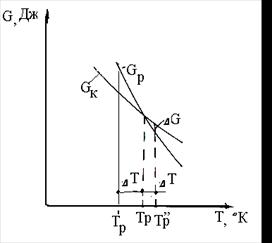 Для того щоб почався фазовий перехід необхідно, щоб процес був термодинамічно вигідним ( Gк < Gр ), що буде можливо тільки при деякому переохолодженні нижче температури Тр на величину ΔТ. Температура, при якій практично починається кристалізація, називається фактичною температурою кристалізації Тр’. Різниця між температурою рівноваги і фактичною температурою кристалізації ΔТ називається ступенем переохолодження (ΔТ= Тр - Тр’’). Ступінь переохолодження залежить від чистоти металу й інтенсивності тепловідводу й у реальних умовах складає 40 - 100°С. Криві охолодження на рис. 4.14 характеризують процес кристалізації чистого металу. Відведення тепла від розплавленого металу викликає плавне зниження температури до Тр в ідеальному випадку чи до Т р’ у реальних умовах, тобто до температури початку кристалізації.
Для того щоб почався фазовий перехід необхідно, щоб процес був термодинамічно вигідним ( Gк < Gр ), що буде можливо тільки при деякому переохолодженні нижче температури Тр на величину ΔТ. Температура, при якій практично починається кристалізація, називається фактичною температурою кристалізації Тр’. Різниця між температурою рівноваги і фактичною температурою кристалізації ΔТ називається ступенем переохолодження (ΔТ= Тр - Тр’’). Ступінь переохолодження залежить від чистоти металу й інтенсивності тепловідводу й у реальних умовах складає 40 - 100°С. Криві охолодження на рис. 4.14 характеризують процес кристалізації чистого металу. Відведення тепла від розплавленого металу викликає плавне зниження температури до Тр в ідеальному випадку чи до Т р’ у реальних умовах, тобто до температури початку кристалізації.
 У процесі кристалізації виділяється схована теплота кристалізації тому, при наступному відведенні тепла від металу на кривої охолодження зниження температури не спостерігається – утворюється «площина». Тільки після закінчення кристалізації знову буде відбуватися зниження температури системи – похила пряма на кривій охолодження.
У процесі кристалізації виділяється схована теплота кристалізації тому, при наступному відведенні тепла від металу на кривої охолодження зниження температури не спостерігається – утворюється «площина». Тільки після закінчення кристалізації знову буде відбуватися зниження температури системи – похила пряма на кривій охолодження.
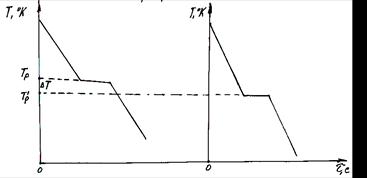 У випадку, якщо фазові перетворення відбуваються при нагріванні, різниця між температурою фазового переходу і температурою рівноваги називається ступенем перегріву
У випадку, якщо фазові перетворення відбуваються при нагріванні, різниця між температурою фазового переходу і температурою рівноваги називається ступенем перегріву
Читайте також:
- Аерозолями називають дисперсні системи, дисперсною фазою яких можуть бути тверді частинки або крапельки рідини, а дисперсійним середовищем є газ ( повітря ).
- Анатерм-114 є клеєм -герметиком прискореного затвердіння, що дозволяє використовувати його у конвеєрних виробництвах при складанні різних вузлів і деталей.
- Барвники і барвні розчини. Приготування
- В'яжучі матеріали та будівельні розчини
- Вивчення теми « Приголосні звуки. Тверді і м’які приголосні, способи їх позначення на письмі »
- Виготовляють розчини трьома способами: масовим, об’ємним та масово – об’ємним.
- Випробовування на твердість.
- Випробування на твердість (статичне випробування)
- Дегазація та дезінфекція, речовини та розчини
- Колоїдні розчини. Будова колоїдних міцел
- Легкі бетони та будівельні розчини
- Механізмів через рейкову колію роблять тверді покриття або переносні насти1
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічні сполуки | | | Діаграми стану металів та сплавів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |