
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Спрямованість хімічних зв'язків пояснюється різним розташуванням електронних хмар у просторі.
Ковалентний зв'язок характеризується насичуваністю та спрямованістю.
Насичуваність ковалентного зв'язку визначається валентними можливостями атомів.
У залежності від того, яку форму та який напрямок мають електронні хмари у просторі під час взаємного перекривання, можуть утворюватися сполуки з лінійною та кутовою будовою молекул.
Тип хімічного зв'язку залежить від того, наскільки велика різниця значень електронегативностей атомів, що сполучаються. Чим більше відрізняються за електронегативністю атоми елементів, що утворюють зв'язок, тим хімічний зв'язок полярніший. Провести чітку межу між типами хімічних зв'язків не можна. Наприклад, у молекулах водню та хлору зв'язок ковалентний неполярний — з'єднуються два атоми з однаковою електронегативністю: Н2 (електронегативність обох атомів 2,1) та С12 (електронегативність обох атомів 3,0). Вони мають спільну електронну пару.
У молекулі хлороводню НС1 зв'язок ковалентний полярний — з'єднуються два атоми з різною електронегативністю (електронегативність Гідрогену 2,1; Хлору — 3,0). Тут спільна електронна пара відтягнута до Хлору.
Ковалентний полярний зв'язок існує у сірководні H2S (електронегативність Гідрогену 2,1; Сульфуру — 2,5), оксидах сірки SO2 та SO3 (електронегативність Сульфуру — 2,5; Оксигену — 3,5), аміаку NH3 (електронегативність Нітрогену 3,0; Гідрогену — 2,1), оксидах карбону CO та СО2 (електронегативність Карбону 2,5; Оксигену — 3,5).
У молекулах хлориду натрію NaCl зв'язок іонний — з'єднуються два атоми з електронегативностями, що дуже відрізняються (електронегативність Натрію 0,9; Хлору — 3,0). Тут Натрій віддає валентний електрон Хлору.
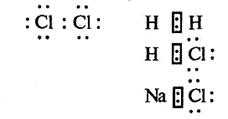 |
Таким чином, іонний зв'язок — крайній випадок прояву ковалентного зв'язку.
Ковалентний хімічний зв'язок між двома атомами, який утворений однією парою електронів, називається одинарним (простим),двома парами електронів — подвійним, трьома парами електронів — потрійним.
Подвійний та потрійний хімічні зв'язки називають кратними.
Розрізняють також σ- та π-ковалентні зв'язки, які відрізняються характером перекривання валентних орбіталей атомів, що взаємодіють, а також симетрією розподілу електронної густини зв'язку по відношенню до лінії, яка з'єднує центри двох атомів.
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |