
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
Вибір індикаторного електроду залежить від типу хімічної реакції, що перебігає в розчині:
1) осадження – індикаторні електроди з металу, катіон якого входить до складу осаду.
2) окисно-відновна реакція – електроди з благородних інертних металів;
3) нейтралізація – електроди, потенціал яких залежить від рН розчину.
1) Осадове титрування. Метод базується на використанні реакцій осадження. Наприклад, а) визначення концентрації іонів срібла титруванням калій йодидом або б) визначення концентрації іонів йоду титруванням розчином арґентум нітратом.
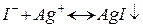 .
.
ДРAgI=10–16; індикаторний електрод – Ag0; електрод порівняння – НКЕ (нормальний каломельний електрод) (ЕНКЕ=0,245 В).
У випадку а) до точки еквівалентності потенціал електроду буде залежати від концентрації іонів срібла відповідно до рівняння Нернста:
 .
.
Після точки еквівалентності концентрація іонів срібла та відповідно потенціал електроду буде визначатися концентрацією іонів йоду:
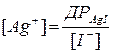 ;
;
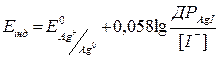 або
або  .
.
У випадку б) відповідно навпаки: до точки еквівалентності потенціал визначається концентрацією I–, після – Ag+.
У точці еквівалентності: 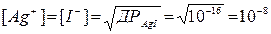 ,
,
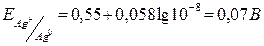 .
.
Величина стрибка титрування залежить: від величини ДР – чим менший добуток розчинності, тим більший стрибок на кривій титрування; від концентрацій речовин – чим більше концентрація, тим більше стрибок.
У присутності в розчині декількох іонів, які утворюють з титрантом малорозчинні сполуки, титрування можна провести послідовно, якщо добутки розчинності (ДР) утворюваних сполук відрізняються хоча б на 4 порядки. Першим титрується іон, що утворює осад з меншим ДР. Наприклад при титруванні суміші хлорид і йодид іонів розчином арґентум нітрату спочатку утворюється осад AgI↓ (ДРAgI=10–16), потім AgCl↓ (ДРAgCl=10–10). В результаті на кривій титрування спостерігаються два стрибки.
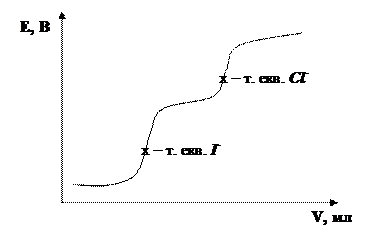

2) Титрування з використанням окисно-відновних реакцій. Метод використовують для визначення іонів, що мають перемінну валентність (Fe, Mn, Cr, Sb, As тощо). В якості індикаторних електродів використовують благородні метали.
У якості приклада можна привести визначення концентрації іонів Fe2+ титруванням стандартним розчином калій біхромату.
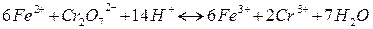 .
.
До точки еквівалентності у розчині будуть присутні іони Fe2+, Fe3+ та Cr3+. Потенціал електроду буде визначатися співвідношенням концентрацій [Fe3+]/[Fe2+]:
 .
.
Після точки еквівалентності у розчині будуть присутні іони Cr2O72–, Cr3+ та Fe3+. Потенціал електроду буде визначатися співвідношенням концентрацій [Cr2O72–]/[Cr3+] та рН розчину, оскільки іони водню приймають участь у цій напівреакції:

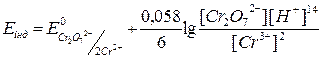 .
.
У точці еквівалентності:
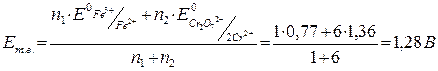 .
.
Величина стрибка титрування залежить від різниці стандартних окисно-відновних потенціалів двох пар (чим більша різниця, тим більша величина стрибка).
Якщо в розчині присутні декілька окисників, що реагують з відновником (та навпаки), то їх можна відтитрувати послідовно. Наприклад суміш MnO4– та VO3– титрують розчином Fe2+: спочатку буде відновлюватись MnO4– до Mn2+, потім VO3– до VO2+.
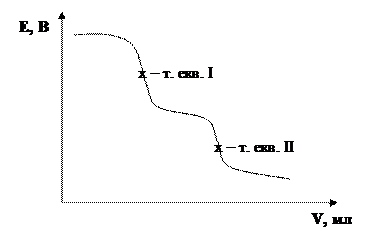 На кривій титрування будуть спостерігатись два стрибки:
На кривій титрування будуть спостерігатись два стрибки:
3) Потенціометричне титрування з використанням реакцій нейтралізації– використовують для визначення концентрації кислот, основ та їх сумішей.
H+ + OH– ↔ H2O.
Потенціал індикаторного електроду прямо пропорційно залежить від концентрації іонів водню. У випадку титрування кислоти лугом до точки еквівалентності:
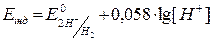 або
або 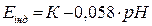 .
.
Після точки еквівалентності у надлишку іонів ОН– : 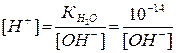
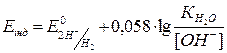 .
.
Можливе визначення концентрацій суміші декількох кислот за умови, що їх константи дисоціації відрізняються хоча б на 3 порядки. Першою буде титруватися більш сильна кислота, та на кривій титрування буде спостерігатися декілька стрибків титрування. Наприклад, у суміші оцтової (Кд=1,7∙10–5) та хлоридної (сильний електроліт) кислот першою реагує з лугом хлоридна кислота, потім оцтова, та на кривій титрування спостерігається два стрибки.
| <== попередня сторінка | | | наступна сторінка ==> |
| Потенціометричне титрування | | | Способи визначення точки еквівалентності |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |