
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ОДНООСНОВНІ КАРБОНОВІ КИСЛОТИ. ЖИРИ
Одноосновними карбоновими кислотами називають похідні вуглеводнів, у яких один атом Гідрогену заміщений на карбоксильну групу – COOН. У цій складній функціональній групі з'єднані дві прості оксигеновмісні групи: карбонільна >С=О і гідроксильна – ОН. Число карбоксильних груп визначає основність кислот. Залежно від характеру вуглеводневого залишку розрізняють насичені, ненасичені й ароматичні карбонові кислоти. Загальна формула гомологічного ряду насичених одноосновних карбонових кислот – C nH2n+1COOH.
Для одноосновних карбонових кислот найуживаніші тривіальні назви, які здебільшого походять із природних джерел першого отримання кислот. За раціональною номенклатурою гомологи кислот розглядаються як похідні оцтової кислоти і називаються за найменуваннями залишків із доданням слів "оцтова кислота". За систематичною номенклатурою IUPAC назви кислот складаються з назв вуглеводнів із тим самим числом атомів Карбону, що і кислоти, із доданням закінчення -ова і слова "кислота".
Залишок будь-якої карбонільної кислоти R–CO–, що уторився при відніманні гідроксильної групи карбоксилу, називається кислотним, або ацильним залишком.
Карбонові кислоти добувають: за. допомогою реакцій (окислення первинних спиртів, альдегідів, олефінів, кетонів; реакцією омилення тригалогенозаміщених похідних, нітрилів, амідів, естерів, ангідридів; реакцій з металоорганічними сполуками й оксосинтезу.
Фізичні властивості кислот залежать від їх складу і будови. За збільшення молекулярної маси розчинність кислот у воді й густина зменшуються, а температура кипіння – збільшується. Кислоти з непарним числом атомів Карбону плавляться при меншій температурі, ніж ближчі кислоти з парним числом атомів Карбону. В етанолі й діетиловому естері кислоти розчинні. Молекули їх асоційовані. У водному розчині кислоти дисоційовані на іони. Під впливом карбонільної групи рухливість атому Гідрогену в гідроксилі настільки збільшується, що він здатний до відщеплення від молекули кислоти у вигляді протона. Це пояснюється зміщенням електронної густини під впливом атома Оксигену карбоксильної групи. Зв'язок між Гідрогеном і атомом Оксигену гідроксильної групи слабкий і відщеплення атома Гідрогену у вигляді йона полегшується:
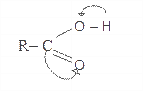
Хімічні властивості одноосновних карбонових кислот зумовлені властивостями карбоксильної групи і зв'язаного з нею вуглеводневого залишку, а також їх взаємним впливом. Усі реакції, що в них вступають кислоти, поділяються на чотири групи:
реакції атома Гідрогену в карбоксилі;
реакції гідроксильних груп;
реакції зв'язаного з карбоксилом вуглеводневого залишку;
реакції карбоксильних груп у цілому.
Карбонові насичені кислоти легко утворюють солі, ангідриди, хлорангідриди, аміди, нітрили, естери і взаємодіють із галогенами, які заміщують атоми Гідрогену залишку, що знаходиться в a-положенні до карбоксильної групи. Ненасичені кислоти, крім того, здатні до реакцій приєднання, окислення і полімеризації.
Органічні сполуки, які у своєму складі мають дві карбоксильні групи, називаються двохосновними карбоновими кислотами, або дикарбоновими. Розрізняють насичені, ненасичені й ароматичні карбонові кислоти. Двохосновні карбонові кислоти мають історичні назви – щавлева, малонова, бурштинова, глутарова, адипінова і т.п. За систематичною номенклатурою IUPAC назви кислот складаються з назв вуглеводнів із тим самим числом атомів Карбону, враховуючи атоми Карбону обох карбоксильних груп, із доданням закінчення -діова та слова "кислота".
Насичені двохосновні карбонові кислоти добувають окисленням гліколей, омиленням динітрилів, через магнійорганічні сполуки; з одноосновних карбонових кислот, за допомогою малонового й ацетооцтового естерів.
За хімічними властивостями двохосновні кислоти аналогічні одноосновним. Завдяки наявності двох карбоксильних груп, вони утворюють два ряди похідних, залежно від того одна чи дві карбоксильні групи вступають у реакцію. Вони утворюють кислі й середні солі, естери, аміди, ангідриди, нітрили, а деякі з них здатні декарбоксилуватися (цис-, трансформи).
Найпростіші ненасичені двохосновні карбонові кислоти – фумарова й малеїнова, які є геометричними ізомерами.
Амідами кислот називаються похідні карбонових кислот, у яких гідроксил карбоксилу заміщений на аміногрупу. Двохосновні карбонові кислоти утворюють повні й неповні аміди. Важливим представником класу амідів є повний амід карбонової кислоти – сечовина, кінцевий продукт нітрогенного обміну в організмі людини й тварин. За добу із сечею людини виділяється до 30 г сечовини – твердої кристалічної речовини, добре розчинної у воді (дає нейтральне середовище) і такої, що гідролізує. Сечовина утворює солі з одним еквівалентом кислоти, під час нагрівання розкладається, перетворюючись у біурет.
| <== попередня сторінка | | | наступна сторінка ==> |
| Дослід 14. ОКИСЛЮВАЛЬНІ ВЛАСТИВОСТІ ХІНОНУ | | | Лабораторна робота № 7 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |