
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Способи виразу концентрації розчинів
Частина 1
«АНАЛІТИЧНА ХІМІЯ»
МЕТОДИЧНІ матеріали
до самостійної роботи студентів
денної форми навчання напрямів підготовки
6.051301 «Хімічна технологія»
6.040106 «Екологія, охорона навколишнього середовища
та збалансоване природокористування»
ЗАТВЕРДЖЕНО
на засіданні кафедри
“Загальної та фізичної хімії”
Протокол № 5 від 17.12.2010
Сєвєродонецьк, 2010
УДК 543
“Аналітична хімія та інструментальні методи аналізу. Частина 1. Аналітична хімія.” Методичні матеріали до самостійної роботи з дисципліни (для студентів денної форми навчання)/ Укладачі О.І. Захарова, О.В.Сергієнко - Сєверодонецьк: Вид-во ТІ, 2010 - 98с.
| Укладачі: | О.І. Захарова, доцент О.В.Сергієнко, асистент |
| Відповідальний за випуск: | Р.Г.Заіка, доцент |
| Рецензент: |
Зміст
| 1. Теоретичні основи аналітичної хімії | |
| 1.1 Способи виразу концентрації розчинів | |
| 1.2 Протолітичні рівноваги в розчинах кислот та основ | |
| 1.3 Рівноваги в буферних розчинах | |
| 1.4 Рівноваги в розчинах солей, які гідролізують | |
| 1.5 Реакції іонного обміну | |
| 1.6 Рівноваги в гетерогенних системах | |
| 1.7 Рівноваги в окисно-відновних реакціях | |
| 2.Розрахунки в титриметричних методах аналізу | |
| 2.1 Розрахунки в методі нейтралізації(кислотно-основного титрування) | |
| 2.2 Розрахунки в методі окисно-відновного титрування | |
| 2.3 Криві титрування | |
| 3. Додатки | |
| Таблиця 1. Найважливіші фізичні сталі | |
| Таблиця 2. Формули для розрахунку рН | |
| Таблиця 3. Густина водних розчинів кислот та основ | |
| Таблиця 4. Константи іонізації важливіших кислот | |
| Таблиця 5. Константи іонізації важливіших основ | |
| Таблиця 6. Іонний добуток води | |
| Таблиця 7. Кислотно-основні індикатори | |
| Таблиця 8. Забарвлення водних розчинів металіндикаторів | |
| Таблиця 9. Добуток розчинності | |
| Таблиця 10. Стандартні електродні потенціали (Ео) при 25оС | |
| 4. Література | |
Теоретичні основи аналітичної хімії
Способи виразу концентрації розчинів
Масова частка розчиненої речовини ω (Х)–цевідношення маси розчиненої речовини m(Х) до маси розчину mр:
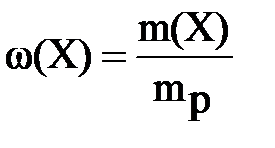 (1)
(1)
Масову частку виражають у частках одиниці або у відсотках (% - сота частка одиниці).
Якщо масова частка натрію хлориду в розчині дорівнює 20%, це означає, що розчин масою 100 г містить 20 г натрію хлориду.
Молярна або мольна часткарозчиненої речовини χх -цевідношення кількості речовини n компонента Х (в молях), що міститься у цьому розчині, до загальної кількості речовин у розчині (в молях):
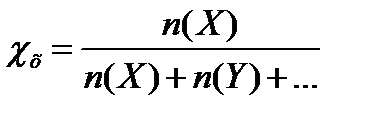 (2)
(2)
Молярну або мольну частку виражають у частках одиниці або у відсотках (% - сота частка одиниці).
Молярна концентрація розчиненої речовинис(Х) –це кількість розчиненої речовини, що міститься в 1 дм3 (1 л) розчину. Молярна концентрація розчиненої речовини Х обчислюється як відношення кількості розчиненої речовини n(Х), до об’єму V розчину (розмірність – моль/дм3, або моль/л):
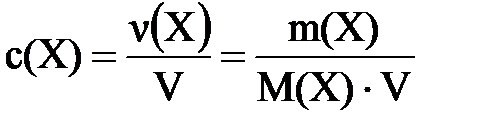 ; (3)
; (3)
де n(Х) або n(X)– кількість речовини(моль); V – об’єм (дм3 або л).
Назви розчинів з різною молярною концентрацією розчиненої речовини:
с = 1 моль/дм3 = 1 М – одномолярний розчин;
с = 0,1 моль/дм3 = 0,1 М - децимолярний розчин;
с = 0,01 моль/дм3 = 0,01 М - сантимолярний розчин;
с = 0,001 моль/дм3 = 0,001 М - мілімолярний розчин.
На практиці також широко використовують молярну концентрацію речовини еквівалента в розчині(сн). Вона є відношенням кількості речовини еквівалента в розчині n(Х)до об’єму цього розчину (розмірність моль/дм3, або моль/л):
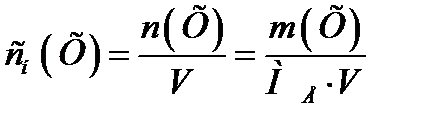 (4)
(4)
Якщо розчин містить 1 моль речовини еквівалента в 1 л, то його називають нормальним. Замість позначення одиниці вимірювання моль/дм3, або моль/л, можна використовувати скорочення «н» або «N». При використанні цих скорочень, необхідно вказувати fекв.Наприклад, 0,1 N КІО3 (fекв=1/6) або 0,1 N (1/6 КІО3).
Переваги використання розчинів з нормальною концентрацією полягають у тому, що розчини з однаковими нормальними концентраціями реагують в однакових об’ємах.
Якщо нормальні концентрації відрізняються, то вірне рівняння:
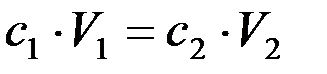 (5)
(5)
Моляльна концентрація розчиненої речовини у розчині (сm) – це відношення кількості розчиненої речовини n(Х) до маси mрозчинникаY.
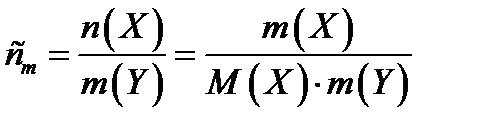 (6)
(6)
Одиниці вимірювання: моль/кг.
Титр розчину - це виражена в грамах маса розчиненої речовини, що міститься в 1 см3 (1 мл) розчину. Титр Т(Х) обчислюють як відношення маси розчиненої речовини m(X) до об’єму розчину (розмірність г/см3, або г/мл):
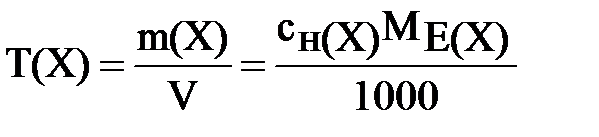 (7)
(7)
Титр титранту за визначуваною речовиноюТ(Y/Х) – виражена в грамах маса визначуваної речовини Х, що еквівалентна 1 мл титранту Y з теоретичною молярною концентрацією речовини еквівалента (розмірність г/см3, або г/мл):
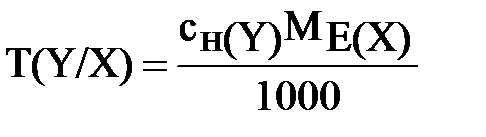 (8)
(8)
| <== попередня сторінка | | | наступна сторінка ==> |
| Занятие №5 (12). | | | Приклади розв’язання задач |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |