
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Еталонні розчини.
Для приблизної оцінки вмісту домішок у лікарській речовині застосовують еталони. Еталон – це зразок, який містить точну наважку (визначену кількість) домішки, яку відкривають.
При приготуванні еталонних розчинів для визначення домішок іонів виходять з чутливості реакції на певний іон. Для цього здебільшого беруть хімічно чисті речовини, що містять ті іони, еталонні розчини яких необхідно приготувати.
Наявність домішок визначають колориметрично або нефелометрично, порівнюваючи результати реакцій у розчині еталона та в розчині лікарської речовини після додавання до однакової кількості реактивів.
Оскільки еталонні розчини – це розчини з точною концентрацію, то ми можемо внаслідок реакції сказати не тільки наявність чи відсутність тої чи інакшої домішки, а також і її кількість.
Еталонні розчини використовують тільки тоді, коли визначають домішки, наявність яких є припустимою державною фармакопеєю в певній кількості. У випадку, коли в статті вказано, що лікарська речовина не має містити певних домішок, то еталонні розчини не використовуються, оскільки даних домішок не має бути взагалі в наявності.
Державна фармакопея при випробуванні лікарського засобу на наявність домішки дає детальні описи умов проведення тих чи інших реакцій. У випадках, коли домішка зустрічається у багатьох лікарських засобах фармакопея не дає докладної методики визначення цієї домішки в окремій статті, а тільки зазначає допустиму межу її в лікарському засобі.
Загальні зауваження при визначенні домішок:
1. Вода та реактиви мають бути вільними від іонів, на які проводять випробування;
2. Пробірки, в яких проводяться випробування, повинні бути безбарвними та однаковими за діаметром;
3. Наважки для приготування еталонних розчинів беруть з точністю до 0,001 г;
4. Еталонні розчини готують безпосередньо перед застосуванням;
спостереження опалесценції проводять на темному, а забарвлення – на
білому фоні;
5. Додавання реактивів до досліджуваного та еталонного розчинів
проводиться одночасно та в однаковій кількості.
6. У випадках, коли у фармакопейній статті вказано, що в розчині тієї чи іншої концентрації не повинно бути виявлено тієї чи інакшої домішки роблять наступним чином: до досліджуваного розчину додають усі наведені реактиви, крім основного, який відкриває цю домішку. Одержаний розчин ділять на дві частини, до однієї дають основний реактив, а до другої – ні, після чого одержані два розчини порівнюють між собою та роблять відповідні висновки. Між ними не повинно бути помітної різниці.
Випробування на граничний вміст домішок:
1.Амонію солі.
Метод А. Домішку визначають за допомогою лужного розчину калію тетрацодмеркурату (реактиву Неслера):
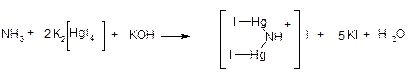
Кількість випробовуваної речовини, зазначену в окремій статті, поміщають у пробірку, розчиняють у 14 мл води , якщо необхідно, підлужують розчином натрію гідроксиду розведеним і доводять об'єм розчину водою до 15 мл. Додають 0,3 мл розчину калію тетрайодмеркурату лужного .
Як еталон використовують розчин, одержаний додаванням до 10 мл еталонного розчину амонію 5 мл води і 0,3 мл розчину калію тетрайодмеркурату лужного. Пробірки закривають.
Через 5 хв жовте забарвлення випробовуваного розчину має бути не інтенсивніше за забарвлення еталону .
Метод В.
Визначення солей амонію рекомендується проводити з папером, просякнутим розчинами AgNO3 і MnSO4. Розчин, що досліджується, термостатують з важким магнію оксидом при 40 0С
 MgO+H2O Mg(OH)2
MgO+H2O Mg(OH)2
 2NH4++ Mg(OH)2 NH3 + H2O + Mg2+
2NH4++ Mg(OH)2 NH3 + H2O + Mg2+
2AgNO3 + MnSO4 + 2H2O  2Ag
2Ag 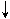 + MgO2
+ MgO2 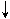 + (NH4)2SO4 + 2NH4NO3
+ (NH4)2SO4 + 2NH4NO3
Паралельно за цих самих умов проводять реакцію з розчином еталону.
Сіре забарвлення паперу, отримане у досліді з випробовуваним розчином, має бути не інтенсивнішим за забарвлення, одержане у досліді з еталоном.
Метод С. Застосовують для зразків , що містять лужноземельні та важкі метали. До розчину випробовуваної речовини додають розчин натрію гідроксиду і натрію карбонату. Осад карбонатів лужноземельних та важких металів відфільтровують. У фільтраті визначають домішку солей амонію взаємодією з лужним розчином калію тетрацодмеркурату (реактивом
Неслера)
Метод Д. Застосовують для зразків, що містять домішку феруму. Спочатку додають калію натрію тартрату в середовищі розчину натрію гідроксиду для зв’язування солей феруму III в комплексну сполуку:
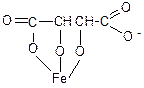
Після цього солі амонію за реакцією з лужним розчином калію тетрацодмеркурату.
Арсен.
Метод А. Оснований на відновленні Арсену з його сполук цинком у кислому середовищі до газоподібного арсину:
6Zn + As2O3 + 12HCl  2AsH3
2AsH3 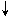 + 3H2O + 6ZnCl2
+ 3H2O + 6ZnCl2
Арсин, що виділився, вступає в реакцію меркурію бромідом (ртутно - бромідний папір), при цьому утворюється кілька продуктів:
AsH3 + HgBr2  AsH2 (HgBr) + HBr
AsH2 (HgBr) + HBr
AsH3 +2HgBr2  AsH2 (HgBr) + 2HBr
AsH2 (HgBr) + 2HBr
AsH3 + 3HgBr2  AsH2 (HgBr) + 3HBr
AsH2 (HgBr) + 3HBr
AsH3 + As(HgBr)3 
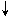 As 2Hg3 + 3HBr
As 2Hg3 + 3HBr
Після промивання у воді та висушування на ртутно - бромідному папері залишається пляма від світло – жовтого (AsH2(HgBr)) до темно – коричневого кольору, (As2Hg3) інтенсивність якого залежить концентрації домішки Арсену.
Визначення проводять у двох приладах: 1- з випробовуваною субстанцією, 2- з еталонним розчином. Реакція відбувається у присутності розчину олова II хлориду, гранульованого цинку, HCl ( р) та розчину КІ.
Для поглинання сіркогідрогену та сірчистого газу, які можуть утворитись в результаті реакції, нижнюю трубку приладу нещільно заповнюють свинцево – ацетатною ватою.
Температура водяної бані не повинна перевищувати 40о С.
Паралельно за цих самих умов проводять дослід з еталоном, що складається з 1 мл еталонного розчину арсену і 24 мл води .
Не менш як через 2 год забарвлення ртутно-бромідного паперу, одержане в досліді з випробовуваним розчином, має бути не інтенсивнішим за забарвлення ртутно-бромідного паперу, одержане в досліді з еталоном.
Метод В.Застосовують у випадку визначення поряд з Арсеном Селену і телуру, а також при визначенні Арсену в зразках, що містять сурму, вісмут, срібло, а також сульфіти і сульфіди.
Дослідження базується на відновленні сполук Арсену натрію гіпофосфітом у присутності кислоти хлористоводневої (к.) та КІ до металевого Арсену:
NaH2PO2 +HCl  NaCl + H3PO2
NaCl + H3PO2
As2O3 + H3PO2  2As
2As 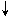 + 3 H3PO3
+ 3 H3PO3
As2O5 + 5 H3PO2  2As
2As 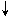 + 5 H3PO3
+ 5 H3PO3
Процес відновлення Арсену відбувається у дві стадії:
2H3PO2  H3PO4 + PH3
H3PO4 + PH3
As2O3 + PH3  2As + H3PO4
2As + H3PO4
Кількість випробовуваної речовини, зазначену в окремій статті, поміщають у пробірку, що містить 4 мл кислоти хлористоводневої і близько 5 мг калію йодиду, і додають 3 мл реактиву гіпофосфіту. Суміш нагрівають на водяній бані протягом 15 хв, час від часу струшуючи.
Паралельно за цих самих умов готують еталон, використовуючи замість випробовуваної речовини 0,5 мл еталонного розчину арсену.
Після нагрівання на водяній бані забарвлення випробовуваного розчину має бути не інтенсивніше за забарвлення еталону.
| <== попередня сторінка | | | наступна сторінка ==> |
| Джерела та причини появи домішок у лікарських засобах. | | | Кальцій. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |