
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні поняття, рівняння і символи
ФІЗИЧНА ХІМІЯ
(Частина ІІ)
МЕТОДИЧНІ ВКАЗІВКИ ТА ЗАВДАННЯ
до самостійної роботи для студентів базових напрямів
051301 "Хімічна технологія"
051401 "Біотехнологія",
051701 "Харчова інженерія",
120201 "Фармація"
Затверджено
на засіданні кафедри
фізичної та колоїдної хімії
Протокол №3 від 6. 11. 2014 р.
Львів – 2015
Фізична хімія, ч.ІІ:Методичні вказівки та завданнядо самостійної роботи для студентів базових напрямів 051301 "Хімічна технологія", 051401 "Біотехнологія", 051701 "Харчова інженерія", 120201 "Фармація"/ Укл.: Ю.А.Раєвський, В.М Дібрівний, В.В.Кочубей, В.В.Сергеєв, І.Б.Собечко. – Львів: Видавництво Львівської політехніки, 2015. - 93 с.
УкладачіРаєвський Ю.А., канд. техн. наук, доц.,
Дібрівний В.М., д-р хім. наук, проф.,
Кочубей В.В., канд. хім. наук, доц.,
Сергеєв В.В., д-р хім. наук, проф.,
Собечко І.Б., канд. хім. наук, ст. викл.
Відповідальні за випускСергеєв В.В., д-р хім. наук, проф.
РецензентСуберляк О.В. В.П., д-р хім. наук, проф.
ВСТУП
Завданням фізичної хімії є передбачення напряму фізико-хімічного процесу та його результату, встановлення зв'язку між властивостями система та її будовою. Дисципліна "Фізична хімія" спрямована на формування у студентів сучасних фізико-хімічних знань і уявлень в галузі теорії та практики прозбавлення хіміко-технологічних процесів і наукових досліджень в хімії. Фізична хімія дозволяє хіміку-технологу вивчати основні фізико-хімічні закони і застосовувати одержані знання для розв'язування конкретних технологічних задач. Розв'язок задач допомагає засвоїти і глибше зрозуміти теоретичні положення курсу.
Дані методичні вказівки допоможуть студентам краще засвоїти матеріал теоретичного та практичного курсів і підготуватися до модульного контролю знань та семестрового контролю з розділів "Розчини електролітів. Електрохімія" та "Хімічна кінетика".
У першій частині методичних вказівок наводяться задачі для самостійної роботи до розділів "Розчини електролітів" та "Електрохімія". У другій частині розглянуто задачі з "Хімічна кінетика". У кожному з розділів наводяться приклади рішення задач, що допоможе студентам у оволодінні алгоритмами розв'язку. В методичних вказівках також подано набір багатоваріантних задач з прикладами їх розв'язку для самостійної роботи студентів.
РОЗЧИНИ ЕЛЕКТРОЛІТІВ. ЕЛЕКТРОХІМІЯ
Основні поняття, рівняння і символи
Електроліти – це хімічні сполуки, які в розчині повністю, або частково, дисоціюють на іони. Розрізняють сильні і слабкі електроліти. Сильні електроліти дисоціюють в розчині на іони практично повністю. Слабкі електроліти дисоціюють в розчині тільки частково. Відношення числа продисоційованих молекул до їх вихідної кількості називається ступенем дисоціації (α).
Питома електропровідність (χ) розчину електроліту – це електропровідність шару електроліту, що знаходиться між двома паралельними електродами, площа кожного з яких 1 м2 і відстань між якими 1 м. Розмірність питомої електропровідності[Ом-1·м-1].Питома електропровідність обернено пропорційна питомому опору.
χ= 1/ρ (1.1)
Питомий опір зв’язаний з опором рівнянням:
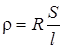 (1.2)
(1.2)
R – опір провідника, Ом; l – довжина провідника, м; S – площа перерізу провідника, м2.
Відношення питомої електропровідності до концентрації називають молярною (еквівалентною) електропровідністю:
λ = χ/С (1.3)
де С – концентрація (моль/м3).
Розмірність еквівалентною електропровідності[Ом-1 см2∙моль-1].
Молярна (еквівалентна) електропровідність зв’язана з абсолютними швидкостями руху іонів рівнянням:
λ = αF(u+ + u-); (1.4)
де α–ступінь дисоціації; F – число Фарадея (F = 96485 Кл/моль);
u+ і u- - абсолютні швидкості іонів [В·м2·с-1]( швидкість руху іону за одиничного градієнту потенціалу у 1В·м-1) .
Fu+ = λ+ і Fu- = λ- - рухливості іонів [ Ом-1м2 моль-1].
Молярна електропровідність за граничного розбавлення дорівнює сумі рухливостей іонів за граничного розбавлення (Закон Кольрауша)
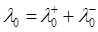 (1.5)
(1.5)
В області малих концентрацій молярна електропровідність сильного електроліту змінюється з концентрацією за емпіричним рівнянням Кольрауша (1.6):
λ = λ0 - а√с (1.6)
де а – емпірична константа, значення якої залежить від природи електроліту і розчинника і не залежить від концентрації.
Для розбавлених розчинів слабких електролітів справедливе рівняння:
lg λ = A – 0.5lgc (1.7)
стала A - також незалежна від концентрації константа.
За відомими значеннями молярної електропровідності даного електроліту (λ) і її значеннями за нескінченого розбавлення (λ0) можна розрахувати ступінь дисоціації електроліту за формулою:
α =λ/λ0 (1.8)
Числом перенесення (tі) називається частка електричних зарядів, що переноситься даним видом іонів.
Числа перенесення зручніше розраховувати за відомими значеннями рухливостей іонів:
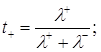
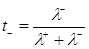 (1.9)
(1.9)
Якщо сполука АnBm дисоціює за рівнянням
АnBm 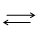 nAm+ + mBn-,
nAm+ + mBn-,
то середнє сумарне число частинок ( іонів і молекул), що утворюються за електролітичної дисоціації однієї молекули, дорівнює ізотонічному коефіцієнту (коефіцієнту Вант-Гоффа) – і.
i = ( n + m - 1)α + 1 (1.10)
Середньо-іонна активність (a±) електроліту АnBm дорівнює:
a± = m±·γ±
де m±·- середньо-іонна моляльність, γ± - середньо-іонний коефіцієнт активності.
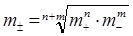 ;
; 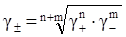 (1.11)
(1.11)
де m+ і m- - моляльності катіону і аніону, γ+ і γ- - коефіцієнти активності катіону і аніону, n і m – число катіонів і аніонів в молекулі електроліту.
Загальна іонна активність зв'язана з середньо-іонною активністю рівнянням:
a = (a±)n+m = 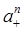 ·
· 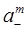 . (1.12)
. (1.12)
Середньо-іонний коефіцієнт активності за малих концентрацій електроліту {до 0,05 моль/(1000 г розчинника)} може бути визначений за граничним рівнянням Дебая і Гюккеля для водних розчинів:
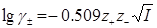 (1.13)
(1.13)
де z+ i z- - заряди катіону і аніону; І – іонна сила розчину електроліту.
І = 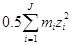 (1.14)
(1.14)
де mі – моляльність і-го іону, zі – заряд і-го іону
Електродним потенціалом (умовним потенціалом) називають величину, рівну ЕРС гальванічного елементу, що складається з даного електрода і стандартного водневого електрода.
Потенціал електроду( 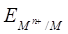 ) , на якому відбувається окисно- відновна реакція Мn+ + ne = M , можна визначити за рівнянням Нернста-Тюріна:
) , на якому відбувається окисно- відновна реакція Мn+ + ne = M , можна визначити за рівнянням Нернста-Тюріна:
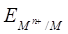 =
= 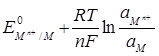 (1.15)
(1.15)
де 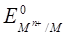 - стандартний електродний потенціал;
- стандартний електродний потенціал;
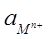 і
і  - активності окисленої і відновленої форм речовини "М".
- активності окисленої і відновленої форм речовини "М".
n – кількість електронів, що приймають участь в елементарній реакції;
F – число Фарадея.
Комбінація з двох електродів, що мають різні електродні потенціали, називається електрохімічним елементом. Його електрорушійна сила (ЕРС) дорівнює різниці потенціалів правого і лівого електродів.
Термодинамічні функції ΔG, ΔS, ΔH, ΔCP, K для реакції, що відбувається в електрохімічному елементі, можна розрахувати за рівняннями:
ΔG = - nFE; (1.16)
ΔS = nF 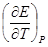 ; (1.17)
; (1.17)
ΔH = - nFE + nTF 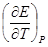 ; (1.18)
; (1.18)
ΔCP = nTF 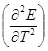 ; (1.19)
; (1.19)
lnK = 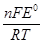 . (1.20)
. (1.20)
К=ехр 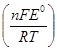 . (1.21)
. (1.21)
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Приклади розв’язку типових задач |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |