
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Приклади розв’язку типових задач
Приклад 1. Розрахуйте ступінь дисоціації і рН розчину фенолу концентрації 1,5·10-4 М за температури 298 К, якщо його константа дисоціації дорівнює Кс=1.01·10-10.
Розв'язок. Фенол (С6Н5ОН) дисоціює з утворенням одного катіону Н+ і одного аніону С6Н5О-:
С6Н5ОН = Н+ + С6Н5О-
(1-α)с αс αс
Для електроліту типу 1-1 константу рівноваги можна записати у вигляді рівняння:
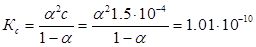
Розв'язок цього квадратного рівняння дає значення ступеня дисоціації α=8.19·10-4. Концентрація іону водню дорівнює:
[H+]= αс = 8,19·10-4·1.5·10-4 = 1,23·10-7.
звідки: рН = - lg[Н+] = - lg1,23·10-7 = 6,91.
Приклад 2. Питома електропровідність розчину пропіонової кислоти С2Н5СООН концентрацією χ = 0.135 моль/л дорівнює 4.79·10-4 Ом-1·см-1. Розрахуйте еквівалентну електропровідність розчину, константу дисоціації кислоти і рН розчину, якщо рухливості Н+ і С2Н5СОО¯ за нескінченого розбавлення дорівнюють 349.8 Ом-1·см2 моль-1 і 37.2 Ом-1·см2 моль-1 відповідно.
Розв’язок. Еквівалентна електропровідність розчину кислоти дорівнює:
λ = χ·1000/С = 4.79·10-4·1000/0.135 = 3.55 Ом-1·см2 моль-1.
Пропіонова кислота відноситься до електролітів типу 1-1 і дисоціює за схемою: С2Н5СООН = С2Н5СОО¯ + Н+
Константа дисоціації кислоти має вигляд:
К = 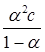
Ступінь дисоціації α можна розрахувати за відомими значеннями еквівалентних електропровідностей розчину електроліту даної концентрації і за нескінченного розбавлення:
α = λ/λ0
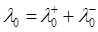 =349.8 + 37.2 = 387
=349.8 + 37.2 = 387
 α = 3.55/387 =0.0092
α = 3.55/387 =0.0092
К = 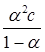 =
= 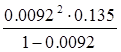 = 1.15·10-5 моль/л
= 1.15·10-5 моль/л
Концентрація іонів водню дорівнює:
[H+] =αc =1.24.10-3 моль/л.
pH = -lg[H+] = 2.91.
Приклад 3. За температури 250С рухливості катіону водню і аніону гідроксилу дорівнюють 3.4982·10-2 м2·ом-1·моль-1 і 1.98·10-2 м2·ом-1·моль-1 відповідно. Розрахуйте молярну електропровідність (λ) і іонний добуток води (Kw), якщо питома електропровідність води дорівнює χ = 5,7·10-6 Ом-1м-1.
Розв’язок. За законом Кольрауша еквівалентна електропровідність електроліту за нескінченного розбавлення дорівнює сумі рухливостей іонів:
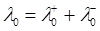 = 3.4982·10-2 + 1.98·10-2 = 5.4782·10-2Ом-1 ·м2·моль-1
= 3.4982·10-2 + 1.98·10-2 = 5.4782·10-2Ом-1 ·м2·моль-1
Молярна концентрація води дорівнює (густина води ρ = 999.87 кг·м-3, молярна маса води М = 18·10-3кг·моль-1):
с= 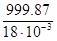 = 55548 моль·м-3
= 55548 моль·м-3
Еквівалентна електропровідність води буде дорівнювати:
λ = χ/с = 5.7·10-6/55548 = 1.026·10-10м2·ом-1·моль-1
Ступінь дисоціації води по відомих значеннях λ і λ0 дорівнює:
α= λ/ λ0 = 1.026·10-10/5.4782·10-2 = 1.8729·10-9
При дисоціації води утворюються іони Н+ і ОН- Концентрації яких:
[Н+]=[ОН-]= αс = 1.8729·10-9·55.548 = 1.04·10-7 моль/л
Іонний добуток води дорівнює добутку концентрацій іонів:
Kw = [Н+]·[ОН-]= (1.04·10-7)2 = 1.0816·10-14.
Приклад 4. Розрахуйте іонну силу розчину, який містить 0.0015 моль H2SO4 i 0.0025 моль Na2SO4 на 1000 г води.
Розв’язок. Іонну силу розраховуємо за рівнянням І = 0.5 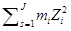
де mі – моляльність і-го іону, zі – заряд і-го іону. Приймаючи до уваги, що розчин містить 1000 г розчинника, число молів кожного компоненту дорівнює його моляльності в розчині. Тоді іонна сила розчину дорівнює:
І = 0.5( 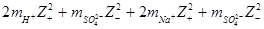 ) =
) =
= 0.5 ( 2·0.0015·12 + 0.0015·22 + 2·0.0025·12 + 0.0025·22) = 0.012
Приклад 5. Для окисно-відновної реакції, що протікає в гальванічному елементі (Mn(OH)2(тв)+H2O2(рід)→MnO2(тв)+2H2O(рід)) зміна ізобарно-ізотермічного потенціалу становить ΔrG0=-190400 Дж. Чому дорівнює стандартна ЕРС елементу?
Розв’язок.ΔrG0 = - nFЕ0, де n – число електронів, що приймають участь в елементарному акті окисно-відновної реакції (n = 2); F – число Фарадея (F = 96480 Кл/моль).
Е0 = 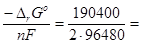 0.987 В.
0.987 В.
Приклад. 6 Складіть схему гальванічного елементу, в якому відбувається реакція Ag+ + Br¯ = AgBr. Розрахуйте стандартну ЕРС елементу за температури 250С, стандартну зміну енергії Гіббса ΔG0, константу рівноваги реакції і розчинність AgBr у воді.
Розв’язок.Схема елементу має вигляд:
Ag | AgBr | Br¯|| Ag+| Ag
На правому електроді відбувається реакція:
Ag+ + е = Ag. Е0пр. = 0.799 B;
На лівому електроді:
AgBr + e = Ag + Br¯ Е0лів. = 0.071B.
При роботі елементу реакція на правому електроді, що має більш позитивний потенціал, протікає у напрямку відновлення, а на лівому – відбувається процес окиснення. Тому загальна реакція, що відбувається у цьому гальванічному елементі, дорівнює алгебраїчній сумі елементарних реакцій на електродах і має вигляд:
Ag+ + Br¯ =AgBr
Стандартна електрорушійна сила елементу дорівнює різниці стандартних потенціалів електродів:
Е0 = Е0пр -Е0лів. = 0.799 – 0.071 = 0.728 В
ΔG0 = -nFE0 = - 1·96485·0.728 = - 70240 Дж/моль.
К =  = 2.024·1012
= 2.024·1012
Константарівноваги реакції Ag+ + Br¯ =AgBr.:
К = 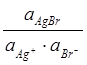
AgBr – чиста конденсована (тверда) сполука, активність якої дорівнює одиниці. Тому:
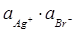 =1/К =
=1/К = 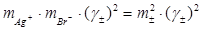
Розчинність AgBr. є дуже малою і середньо-іонний коефіцієнт ( 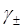 ) можна прийняти рівним одиниці. Тоді розчинність AgBr дорівнює:
) можна прийняти рівним одиниці. Тоді розчинність AgBr дорівнює:
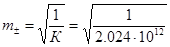 = 7.029·10-7 моль/кг
= 7.029·10-7 моль/кг
Приклад 7. Температурна залежність стандартної електрорушійної сили свинцевого акумулятора має вигляд: Е0 = 2.1191 + 1.62·10-4 t+ 8.5·10-7 t2 . Розрахуйте ΔG0, ΔS0, ΔH0 iΔCp за t=250С для реакції, що відбувається в акумуляторі у процесі його розрядки:
Pb(тв) + PbO2(тв) + 2H2SO4(рід) → 2PbSO4(тв) + 2H2O(рід) .
Розв’язок. ΔG0=-nFE0, де n – число електронів, що приймають участь в елементарному окисно-відновному акті (n=2), F = 96480 Кл/моль – число Фарадея, Е – стандартна електрорушійна сила.
ΔG0 = -2·96480·(2.1191 + 1.62·10-4 25+ 8.5·10-7 252) = - 409786 Дж
Зміна ентропії може бути визначена за рівнянням;
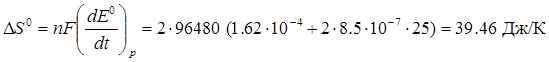
Значення теплового ефекту реакції можна розрахувати за рівнянням:
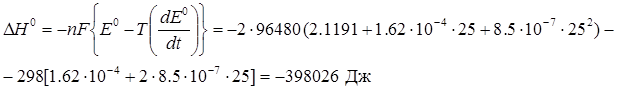
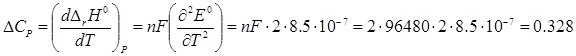 Дж/К
Дж/К
Приклад 8. У нескінченно розбавленому розчині еквівалентна рухливість катіону К+ становить 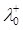 = 7.352·10-3Ом-1·м2·моль-1.Чому дорівнює швидкість руху К+ в електричному полі з градієнтом напруги Н=152 В/м?
= 7.352·10-3Ом-1·м2·моль-1.Чому дорівнює швидкість руху К+ в електричному полі з градієнтом напруги Н=152 В/м?
Розв’язок.Швидкість руху іону в електричному полі (V) можна визначити як добуток абсолютної рухливості (К+) і напруженості електричного поля (градієнта напруги) - Н Абсолютну рухливістьіону розраховуємо за формулою:
К+ = 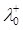 /F
/F
де F = 96480 Кл/моль– число Фарадея.
К+ =7.352·10-3/96480 = 7.620·10-8 м2/(В с)
За відомим значенням абсолютної рухливості визначаємо швидкість руху іону в електричному полі:
V+ = K+·H = 7.620·10-8·152 = 1.16·10-5 м/с
Приклад 9.Розрахуйте теплоту дисоціації (ΔНдис) і загальну теплоту нейтралізації (ΔНнейтр) мурашиної кислоти за температури 298К у розбавленому водному розчині лугу, якщо температурна залежність константи дисоціації кислоти підпорядковується рівнянню:
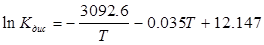 .
.
Теплота нейтралізації кислоти дорівнює ΔНнейтр. = -55.94 кДж/моль.
Розв’язок.Теплоту дисоціації можна розрахувати, використовуючи рівняння ізобари:
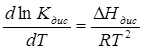 , звідки
, звідки 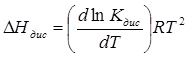

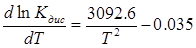
Теплота дисоціації дорівнює:
ΔНдис = -0.035 RT2 + 3092.6R = -129.2 Дж/моль
Термохімічне рівняння нейтралізації мурашиної кислоти має вигляд:
НСООН + ОН- = НСОО- + Н2О + ΔН
Це рівняння можна розглядати як алгебраїчну суму рівнянь двох реакцій:
реакції дисоціації НСООН = НСОО- + Н+ + ΔНдис.
реакції нейтралізації Н+ + ОН- + Н2О + ΔНнейтр.
Звідки загально теплота нейтралізації мурашиної кислоти в розбавленому розчині буде дорівнювати:
ΔН = ΔНдис + ΔНнейтр. = -56069 Дж/моль
Приклад 10. За даними про стандартні електродні потенціали цезію і кадмію розрахуйте за температури 298 К ЕРС елементу, складеного з електродів:
Cs | Cs+ ( 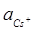 = 0.03) i Cd | Cd2+ (
= 0.03) i Cd | Cd2+ ( 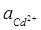 = 0.05).
= 0.05).
Розв’язок.Розрахуємо ЕРС елементу як різницю потенціалів електродів. Значення стандартних електродних потенціалів знаходимо у довіднику:
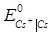 = -2.923 В;
= -2.923 В; 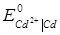 = - 0.403 В. Потенціал кадмієвого електроду більш позитивний, ніж цезієвий, тому віднімаємо від значення електродного потенціалу кадмієвого електроду значення потенціалу цезієвого:
= - 0.403 В. Потенціал кадмієвого електроду більш позитивний, ніж цезієвий, тому віднімаємо від значення електродного потенціалу кадмієвого електроду значення потенціалу цезієвого:
Е = 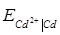 -
- 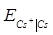 =
= 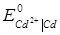 -
- 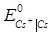 +
+ 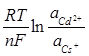
Е = (-0.403) – (-2.923) + 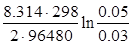 = 2.527 В.
= 2.527 В.
Приклад 11. За значеннями стандартних електродних потенціалів для реакції
Zn + H2SO4(розч.) = ZnSO4(розч.) + Н2
вкажіть напрямок протікання реакції за стандартних умов і наведіть схему відповідного електрохімічного елементу.
Розв’язок. Загальна окисно-відновна реакція, яка протікає у гальванічному елементі, може бути представлена як дві елементарні окисно-відновні реакції, що відбуваються на електродах:
І) 2Н+ + 2е = Н2
ІІ) Zn2+ + 2e = Zn
Стандартні електродні потенціали, що відповідають наведеним електродним реакціям дорівнюють: ЕІ = 0, ЕІІ = -0763 В. ЕІ >ЕІІ, тому від рівняння (І) необхідно відняти рівняння (ІІ) (у цьому випадку ЕРС>0). Тоді загальна реакція, що буде відбуватися у цьому гальванічному елементі, може бути записана:
2Н+ + Zn = Н2 + Zn2+
Схему гальванічного елементу записуємо таким чином, щоби справа знаходився більш позитивний (водневий), а зліва – більш негативний (цинковий) електроди:
Zn | ZnSo4 || H2SO4 | H2 | Pt
Приклад 12. Розрахуйте потенціал хлорного електроду і ЕРС газового елементу
Pt | H2 | HCl | Cl2 | Pt
за температури 298К , якщо тиск водню у водневому електроді дорівнює 1 атм, а хлору у хлорному електроді – 2 атм. Моляльність НСІ дорівнює 0.2, а середньо-іонний коефіцієнт активності 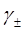 =0.796. Стандартні електродні потенціали електродів дорівнюють:
=0.796. Стандартні електродні потенціали електродів дорівнюють: 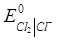 = 1.360 В;
= 1.360 В; 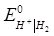 = 0 В.
= 0 В.
Розв’язок. Потенціал хлорного електроду, на якому відбувається окисно-відновна реакція 0.5Cl2 + е = Cl,- розраховуємо за рівнянням Нернста-Тюріна:
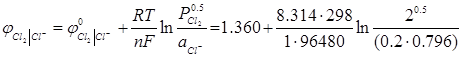 = 1.434 В.
= 1.434 В.
На водневому електроді відбувається реакція (процес відновлення):
Н+ + е = 0.5Н2
Потенціал водневого електроду може бути розрахований за рівнянням:
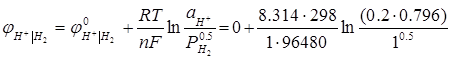 = - 0.047 В.
= - 0.047 В.
Електрорушійна сила елементу дорівнює різниці потенціалів правого і лівого електродів:
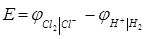 = 1.434 – (-0.047) = 1.481 В.
= 1.434 – (-0.047) = 1.481 В.
Приклад 13. Розрахуйте ступінь дисоціації води за температури 298К, якщо її питома електропровідність становить χ = 6.33·10-8 Ом-1·см-1. Рухливості іонів Н+ і ОН- за нескінченого розбавлення становлять λ+ =349.8 Ом-1·моль-1·см2, λ-=198.3 Ом-1·моль-1·см2.Густину води прийняти рівною ρ = 1 г/см3.
Розв’язок. Ступінь дисоціації можна визначити, скориставшись рівнянням:
α =λ/λ0
де λ – еквівалентна електропровідність розчину електроліту концентрації "с", а λ0 – його еквівалентна електропровідність у нескінченно розбавленому розчині.
λ = χ/с.
Кількість молів води в 1 літрі (концентрація) становить:
с= 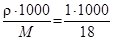 = 55.56 моль/л = 55.56·10-3 моль/см3.
= 55.56 моль/л = 55.56·10-3 моль/см3.
Тоді еквівалентна електропровідність буде дорівнювати:
λ = χ/с = 6.33·10-8/ 55.56·10-3 = 1.139·10-6 Ом-1·моль-1·см2.
Еквівалентна електропровідність за нескінченного розбавлення за законом Кольрауша дорівнює сумі рухливостей іонів за нескінченного розбавлення:
λ0 = λ+ + λ- = 349.8 + 198.3 = 548.1 Ом-1·моль-1·см2.
Ступінь дисоціації дорівнює:
α =λ/λ0 = 1.139·10-6/548.1 = 2.08·10-9.
Приклад 14.Розрахуйте константу рівноваги реакції Zn+Cd2+=Zn2++Cd двома способами: а) з використанням термодинамічних даних про реагенти ( 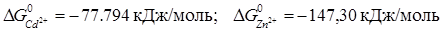 ); б) за відомими значеннями електродних потенціалів:
); б) за відомими значеннями електродних потенціалів: 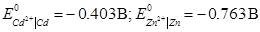 . Реакція відбувається за температури 298К.
. Реакція відбувається за температури 298К.
Розв’язок.а) Константа рівноваги реакції може бути розрахована за рівнянням 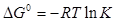 . Зміну енергії Гіббса реакції можна визначити як різницю відповідних кінцевих і вихідних значень енергій Гіббса реагентів.
. Зміну енергії Гіббса реакції можна визначити як різницю відповідних кінцевих і вихідних значень енергій Гіббса реагентів.
Враховуючи, що стандартні зміни енергії Гіббса чистих конденсованих речовин дорівнюють нулеві ( 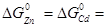 0), то
0), то 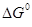 =
= 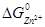 -
- 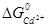 = -147.30 – (-77.794) =-69.506 кДж/моль = -69560 Дж/моль. Константа рівноваги дорівнює:
= -147.30 – (-77.794) =-69.506 кДж/моль = -69560 Дж/моль. Константа рівноваги дорівнює:
К = ехр 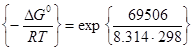 = 1.527·1012 .
= 1.527·1012 .
б) За відомими значеннями стандартних потенціалів електродів гальванічного елементу, в якому відбувається дана окисно-відновна реакція,
Zn | Zn2+ ||Cd2+ | Cd
константа рівноваги може бути визначена за формулою:
К = ехр 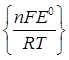
Стандартну електрорушійну силу можна визначити як різницю стандартних потенціалів правого і лівого електродів:
Е0 = - 0.403 – (- 0.763) = 0.360 В.
Число електронів, що приймають участь в елементарній окисно-відновній реакції n = 2. Тоді константа дорівнює:
К =ехр 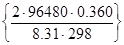 = 1.522·1012
= 1.522·1012
Розбіжність двох методів визначення константи рівноваги реакції не перевищує 0.25%.
Приклад 15. Розрахуйте корисну роботу окисно-відновної реакції за температури 298К, що відбувається в гальванічному елементі
Ag | AgCl | Cl- | Cl2, Pt,
якщо тиск хлору у хлорному електроді дорівнює 1 атм, а активність іону хлору дорівнює 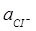 = 1.
= 1.
| <== попередня сторінка | | | наступна сторінка ==> |
| Основні поняття, рівняння і символи | | | Розв’язок. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |