
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розв’язок.
Корисна робота за сталих значень тиску і температури дорівнює від'ємному значенню зміни енергії Гіббса: W = - ΔG. Зміна енергії Гіббса за стандартних умов (тиск газу і активність іону дорівнюють одиниці) може бути визначена за формулою:
ΔG0 = - nFE0
У довіднику фізико-хімічних величин знаходимо значення стандартних електродних потенціалів даного гальванічного елементу:
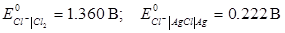
Стандартна електрорушійна сила елементу дорівнює різниці стандартних електродних потенціалів:
Е0 = 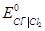 -
- 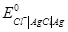 = 1.360 – 0.222 = 1.138 В.
= 1.360 – 0.222 = 1.138 В.
Корисна робота, що виконується у даному елементі, дорівнює (n = 1):
W = - ΔG0 = nFE0 = 1·96480·1.138 = 109784 Дж/моль = 109.78 кДж/моль.
Приклад 16.ΔН реакції Pb + Hg2СІ2 = PbСІ2 + 2Hg, що відбувається у гальванічному елементі, дорівнює -94.2 кДж/моль за температури 298 К. При підвищенні температури на 1 К ЕРС цього елементу зростає на 1.45·10-4 В. Розрахуйте величину ЕРС цього елементу і ΔS за температури 298 К.
Розв’язок.Зміна ЕРС елементу при нагріванні системи на 1 градус являє собою температурний коефіцієнт ЕРС - 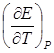 . Тому зміна ентропії дорівнює:
. Тому зміна ентропії дорівнює:
ΔS = n·F 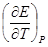 = 296480·1.45·10-4 = 28.0 Дж/(моль·К)
= 296480·1.45·10-4 = 28.0 Дж/(моль·К)
ΔG = ΔН - Т·ΔS= - nFE
Звідки Е = 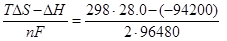 = 0.5314 В.
= 0.5314 В.
Приклад 17.У гальванічному елементі відбувається окисно-відновна реакція
Pb + Hg2SO4 = PbSO4 + 2Hg.
Користуючись даними таблиць стандартних термодинамічних величин для реагентів, наведіть схему цього гальванічного елементу, розрахуйте його ЕРС за температури 298 К і визначить температурний коефіцієнт ЕРС 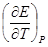 .
.
Розв’язок. На електродах цього гальванічного елементу відбуваються наступні окисно-відновні реакції:
Pb2+ + 2e = Pb E0 = - 0.126 B
Hg2SO4 + 2e = 2Hg + SO42- E0 = +0.615 B.
Ртутний електрод є більш електропозитивний і тому цей електрод записуємо в схемі елементу праворуч:
Pb | PbSO4(тв) | Na2SO4 | Hg2SO4(тв) | Hg
Для визначення 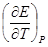 скористаємось рівнянням звязку між зміною ентропії реакції і температурним коефіцієнтом ЕРС:
скористаємось рівнянням звязку між зміною ентропії реакції і температурним коефіцієнтом ЕРС:
ΔS = n·F 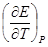 .
.
Електрорушійну силу елементу розраховуємо з рівняння:
ΔG = - nFE = ΔН - Т·ΔS = ΔН - Т n·F 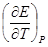 . Звідки:
. Звідки: 
Е = 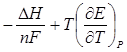
Для визначення змін ентропії і ентальпії в ході реакції скористаємось довідниковими даними термодинамічних величин:
| Сполука | Pb | PbSO4(тв | Hg2SO4(тв) | Hg |
| S0, Дж/(моль·К) | 64,81 | 148,67 | 200,71 | 75,90 |
| ΔfН0298 кДж/(моль) | -920,48 | -744,65 |
ΔS0=2 S0Hg+ 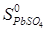 -
- 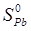 -
- 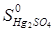 =2·75.9+148.67–64.81–200.71=34.95 Дж/К
=2·75.9+148.67–64.81–200.71=34.95 Дж/К
Звідки: 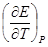 = ΔS / (n·F)= 34.95/ (2·96480) = 1.81·10-4 В/К
= ΔS / (n·F)= 34.95/ (2·96480) = 1.81·10-4 В/К
ΔН0 = 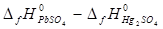 = -920.48 – (-744.65) = -175.11 Кдж = 175110 Дж.
= -920.48 – (-744.65) = -175.11 Кдж = 175110 Дж.
ЕРС даного гальванічного елементу дорівнює:
Е = 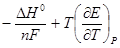 =
= 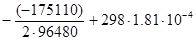 = 0.961 В.
= 0.961 В.
1.3 Завдання для самостійної роботи
| <== попередня сторінка | | | наступна сторінка ==> |
| Приклади розв’язку типових задач | | | Задача 1.1 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |