
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Вихідні дані
| Розчин електроліту | Т, К | 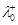
| 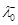
| Пара-метри | Залежність питомого опору (ρ, Ом·м), електроліту від концентрації (с, моль/м3), за даної температури | |||||
| Ом-1м2· кмоль-1 | ||||||||||
| Н3РО4 | 35,0 31.5 | 3,6 2,8 | Т | |||||||
| С | 31,25 | 15,63 | 7,81 | 3,91 | 1,95 | |||||
| ρ | 2,048 | 3,212 | 5,227 | 8,881 | 15,79 | 1,213 |
1. Для побудови графіків залежності питомої і молярної електропровідності від концентрації необхідно розрахувати χі λза температури 298 К для заданого діапазону концентрацій за рівняннями
χ = 1/ρі λ = χ/с.
Розраховані значення питомої і молярної електропровідності заносимо в табл.1.3
Таблиця 1.3
Значення питомої і молярної електропровідності
| С, моль/м3 | 31,25 | 15,63 | 7,81 | 3,91 | 1,95 |
| χ, Ом-1 м-1 | 0,4884 | 0,3113 | 0,1913 | 0,1126 | 0,06332 |
| λ, Ом-1 см2∙кмоль-1 | 15,63 | 19,92 | 24,49 | 28,82 | 32,42 |
За даними табл.1.3 будуємо графіки залежності χ і λ від концентрації (Рис.1.1 і 1.2).
2.Для того, щоб визначити до якого типу електролітів відноситься даний електроліт (сильний, чи слабкий), необхідно визначити константу його дисоціації при різних концентраціях. Якщо константа дисоціації не змінюється при зміні концентрації – даний електроліт відноситься до слабких електролітів. Якщо константа змінюється – електроліт відноситься до сильних електролітів.
Дані, що наведені в табл. 1.2, відповідають дисоціації Н3РО4 на один катіон (Н+) і один аніон (Н2РО4-). Закон розбавлення Оствальда для таких електролітів (типу 1-1) записується:
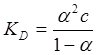
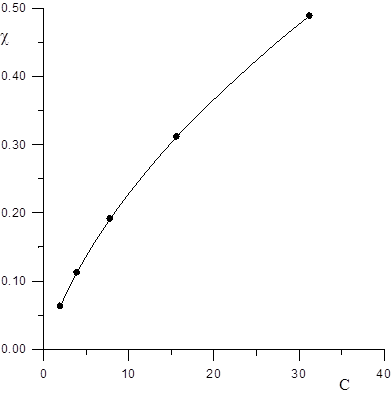
Рис. 1.1. Залежність питомої електропровідності від концентрації електроліту.
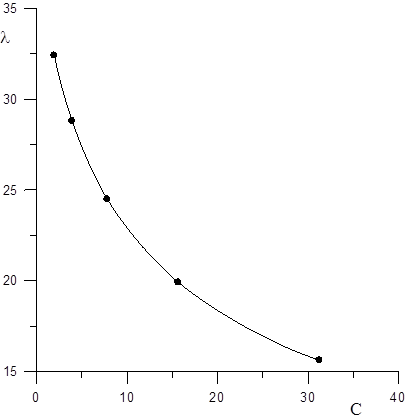
Рис. 1.2 Залежність молярної електропровідності від концентрації електроліту.
Для визначення ступеня дисоціації α за різних концентрацій необхідно визначити молярну електропровідність за нескінченного розбавлення і температури 298 К - λ∞.Для цього можна скористатися законом Кольрауша (1.5). Дані про рухливість іонів за температури 298 К наведені в табл.1.2
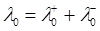 =35,0+3,6 = 38,6 (Ом-1м2 ·кмоль-1)
=35,0+3,6 = 38,6 (Ом-1м2 ·кмоль-1)
За рівнянням α = λ/λ0, скориставшись даними про значення молярної електропровідності за різних концентрацій електроліту (табл.1.3), визначаємо α.
α1 = 15,63/38,6=0,4049; α2=19,92/38,6 = 0,5160 і т.д
Підставляючи значення αі відповідні значення концентрацій в рівняння константи дисоціації, визначаємо величину константи за різних концентрацій.
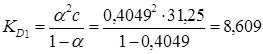 і т.д. для всіх значень α і С.
і т.д. для всіх значень α і С.
Одержані результати заносимо в табл. 1.4.
Таблиця 1.4
| С, моль/м3 | 31,25 | 15,63 | 7,81 | 3,91 | 1,95 |
| α | 0,4049 | 0,5160 | 0,6345 | 0,7467 | 0,8400 |
| КD | 8,609 | 8,596 | 8,605 | 8,598 | 8,613 |
KD(сер) = 8,604
Значення константи дисоціації практично не змінюються в розглянутому діапазоні концентрацій (∆ = 1,05%). Це означає, що даний розчин підпорядковується закону розбавлення Оствальда і відноситься до слабких електролітів. Надалі виконуємо лише ті пункти багатоваріантної задачі, які стосуються слабких електролітів: п.п. 3, 5, 7 і 9.
3. Для визначення концентрації розчину, за якої ступінь дисоціації електроліту становить 0.1, скористаємось виразом для константи дисоціації і розв’яжемо його відносно концентрації за умовою, що α = 0.1 а KD(сер) = 8,604:
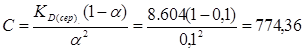
При дисоціації Н3РО4 за схемою Н3РО4 = Н+ + Н2РО4 – для слабких електролітів в області малих концентрацій замість активності можна використовувати концентрацію. Концентрація іонів [H+] = [Н2РО4 –] = cα. Тоді рН = - lg[H+] = - lg (cα)
pH = - lg(774,36·0,1) = 1,89
5.Для визначення KDі λ0, не використовуючи дані про рухливість іонів, скористаємось графічною інтерпретацією рівняння зв’язку константи дисоціації і молярної електропровідності для електроліту типу1-1 у вигляді:
1/λ = 1/λ0 + (λс) /( 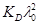 ) (1.22)
) (1.22)
Для цього розрахуємо значення 1/λ і λс для вказаних в завданні концентрацій за температури 298 К. Результати розрахунків наведені в табл.1.5.
Таблиця 1.5
| С, моль/м3 | 31,25 | 15,63 | 7,81 | 3,91 | 1,95 |
| 1/λ | 63,98 | 50,21 | 40,83 | 34,72 | 30,80 |
| λC | 0,4884 | 0,3113 | 0,1913 | 0,1126 | 0,06332 |
За даними табл.1.5 будуємо графік в координатах 1/ λ = f (λc).
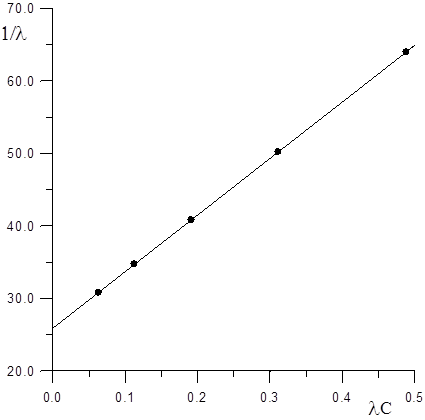
Рис. 1.3 Залежність 1/ λ від λc
Точка перетину прямої з віссю ординат при λС = 0 дорівнює 1/λ0 = 25,9. Звідси λ0= 1/25,9 = 0,0386 Ом-1м2·моль-1 (Табличне значення λ0,розраховане за законом Кольрауша, дорівнює 38.60 Ом-1м2·кмоль-1).
Значення константи дисоціації розраховуємо по тангенсу кута нахилу прямої. В координатах 1/ λ = f(λc)він дорівнює кутовому коефіцієнту рівняння (1.22):
tgα= 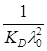 , а константа дисоціації KD=
, а константа дисоціації KD= 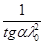
За графіком tgα= 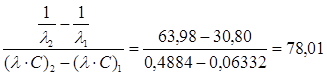
KD= 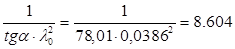
Середнє значення константи дисоціації, розраховане в п.2 співпадає з константою дисоціації, визначеною за графіком.
7.Для визначення теплового ефекту дисоціації необхідно знати як мінімум дві константи дисоціації за двох температур. За температури 298К константа дисоціації розрахована і дорівнює KD(сер) = KD1= 8,604. Другу константу (KD2)можна розрахувати з вихідних даних (табл.1.2) за температури 291К. Аналогічно розрахункам, проведеним в п.2, визначаємо ступінь дисоціації α.
χ = 1/ρ = 1/1,213 = 0,8244 (Ом-1·м-1);
λ = χ/с = 0,8244/0,1 = 8,244 (Ом-1м2·кмоль-1);
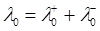 = 31,5 +2,8 = 34,3 (Ом-1м2·кмоль-1);
= 31,5 +2,8 = 34,3 (Ом-1м2·кмоль-1);
α = λ/λ0 =8,244/34,3 = 0,240
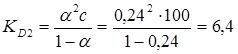
По двох відомих константах за двох температур теплоту дисоціації можна розрахувати за рівнянням:
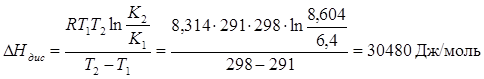
9.Розрахувати ізотонічний коефіцієнт можна за рівнянням (1.10). За умовою задачі розрахунок необхідно провести при найменшій концентрації розчину в завданні (с=1,953 моль/м3). Ступінь дисоціації електроліту при цій концентрації дорівнює ( табл. 1.4) α=0,84. Для електроліту типу 1-1 число катіонів і аніонів дорівнюють n = m = 1. Ізотонічний коефіцієнт розчину Н3РО4 за концентрації с=1,953 моль/м3 дорівнює:
i=(n+m -1)α + 1 = ( 1 + 1 – 1) 0,84 + 1 = 1,84.
б) Приклад розв’язку задачі для сильного електроліту
Необхідні для розрахунку дані знаходимо в табл.1.1 і записуємо в табл. 1.6.
Таблиця 1.6
| <== попередня сторінка | | | наступна сторінка ==> |
| Приклад розв’язку задачі 1.1 | | | Вихідні дані |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |