
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Вихідні дані
| Розчин елекро- літу. | Т, К | 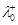
| 
| Пара-метри | Залежність питомого опору ρ, Ом·м, електроліту від концентрації с ( моль/м3) за даної температури | |||||
| Ом-1м 2∙ кмоль-1 | ||||||||||
| KF | 7,35 6,39 | 5,54 4,73 | Т | |||||||
| С | 50,0 | 30,0 | 10,0 | 5,00 | ||||||
| ρ | 0,905 | 1,755 | 2,86 | 8,283 | 16,3 | 0,822 |
п.п.1,2 виконуються ідентично попередній задачі. Розраховані значення констант дисоціації за різних концентрацій електроліту наведені в табл. 1.7.
Таблиця 1.7
| С, моль/м3 | 50,0 | 30,0 | 10,0 | 5,00 | |
| КD | 512,6 | 336,7 | 253,0 | 138,0 | 94,0 |
Значення констант дисоціації змінюються при зміні концентрації розчину електроліту. Це означає, що даний електроліт не підпорядковується закону розбавлення Оствальда і відноситься до сильних електролітів. Тому надалі виконуємо лише ті пункти багатоваріантної задачі, які стосуються сильних електролітів: п.п. 4, 6, 8 і 10.
4.Для сильного електроліту не можна прирівняти активність до концентрації і тому при розрахунку рН ( для даного електроліту – рК) необхідно скористатися активністю.
Активність за даної концентрації може бути розрахована, якщо відомий середньо-іонний коефіцієнт активності (γ±), за рівнянням: а± = γ±с. Середньо-іонний коефіцієнт активності можна розрахувати, скориставшись законом іонної сили, за рівнянням Дебая-Гюккеля (1.13):
lg γ± = - AZ+Z-√I
де А – коефіцієнт, який для водних розчинів електролітів за Т=298К дорівнює 0,509; Z+ , Z- - заряди катіону і аніону відповідно (для електроліту типу 1-1 Z+ = Z- =1);
І - іонна сила розчину, яка розраховується за рівнянням:
І = ½ΣсіZi2
Розрахуємо спочатку іонну силу електроліту KF за концентрації с = 100моль/м3 = 0,1 моль/л:
І = 0,5 (0,1 12 + 0,1·12) = 0,1 моль/л
З рівняння (1.13) знаходимо середньо-іонний коефіцієнт активності:
lg γ± = - AZ+Z-√I = -0,509·1·1·√0,1= -0,161; звідки γ± =0,690.
Активність іонів буде дорівнювати: а± = γ±с = 0.69·0.1= 0.069
рН розчину ( у випадку KF - рК) дорівнює: рК = - lg а± = - lg 0,069 = 1,16.
6.Для побудови графіку залежності молярної електропровідності від √сзначення λ, розраховані в п.1 задачі, і √спри різних концентраціях заносимо в табл.1.8.
Таблиця 1.8
| С, моль/м3 | 50,0 | 30,0 | 10,0 | 5,00 | |
| λ, Ом -1м 2·кмоль-1 | 11,044 | 11,394 | 11,641 | 12,073 | 12,269 |
| √с, ( моль/м3)0.5 | 10,00 | 7,07 | 5,48 | 3,16 | 2,24 |
З графічної залежності (рис.1.4) λ від √секстраполяцією прямої на вісь ординат до √с = 0 знаходимо λ0= 12,57 Ом-1м2·кмоль-1.
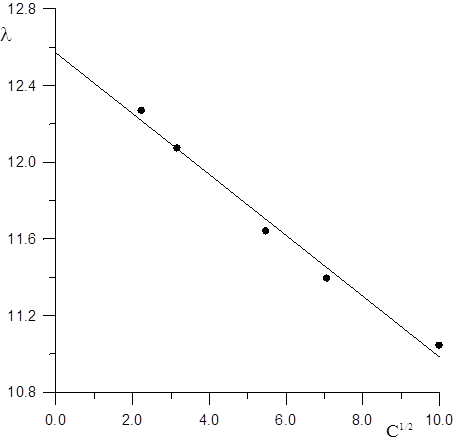
Рис. 1.4.Залежність молярної електропровідності від √с
За табличними даними 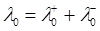 =7,35+5,54 = 12,89 Ом -1м2·кмоль-1.
=7,35+5,54 = 12,89 Ом -1м2·кмоль-1.
Стала рівняння Кольрауша -а (кутовий коефіцієнт рівняння) дорівнює тангенсу кута нахилу прямої в координатах λ - √с.
-а = tgα = 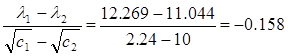
Знак (-) врахований в рівнянні Кольрауша, тому остаточно а = 0,158.
8. Для розрахунку чисел перенесення іонів скористаємось вихідними даними (таблиця 1.6) про рухливість іонів (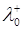 і
і 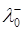 ) за температури 298К і розрахуємо значення t+ i t- за рівнянням (1.9).
) за температури 298К і розрахуємо значення t+ i t- за рівнянням (1.9).
Для температури Т=291:
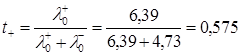
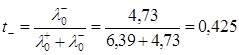
Для температури Т=298:
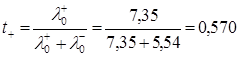
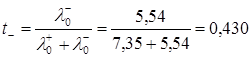
10. Абсолютну рухливість іонів u+ іu- можна визначити з рівнянь:
FК+ = λ0+ і FК- = λ0-
Звідки: за температури 298 К:
К+ = λ0+/F=7.35/96480=7.62·10-5 м/с., К- =λ-/F=5.54 /96480 =5.74·10-5 м/с.
За температури 291 К:
К+ = 6.39/96480 =6.62·10-5 м/с., К- =4.73/96480 =4.90·10-5 м/с.
| <== попередня сторінка | | | наступна сторінка ==> |
| Вихідні дані | | | Контрольні задачі |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |