
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Контрольні задачі
1. Розрахуйте іонну силу і середні іонні коефіцієнти активності для розчинів суміші електролітів за 298 К, якщо моляльність електролітів в розчинах становлять: a) Na2SO4 – 0.005, MgSO4 – 0.003; b) MgSO4 – 0.005, LaCl3 – 0.006.
2. Розрахуйте моляльність розчину Al(NO3)3 іонна сила якого дорівнює 0.3 моль/кг.
3. Іонна сила розчину NaNO3 становить 0.30 моль/кг. Чому дорівнює моляльність розчину Al2(SO4)3 з такою самою іонною силою.
4. Обчисліть іонну силу і середні коефіцієнти активності солей в розчинах 1 і 2. Моляльні концентрації солей вказані в таблиці.
| № розчину | Na2SO4 | CeCl3 | ZnSO4 |
| 0,015 | 0,05 | 0,025 | |
| 0.001 | 0.003 | 0.006 |
5.Розрахуйте іонну силу розчину, що містить 0.1 моль/кг КСІ і 0.20 моль/кг ZnSO4.
6. Чому дорівнює моляльність розчину К3РО4, що має таку ж іонну силу, що і 0.38 моль/кг розчин КСІ?
7. Константа дисоціації NH4OH дорівнює 1.79∙10-5. Визначити концентрацію NH4OH, за якої ступінь дисоціації дорівнює 0.01 і еквівалентну електропровідність розчину, якщо рухливості іонів NH+ OH-відповідно дорівнюють 73.5 і 198.3 Ом-1см2моль-1.
8. Розчин слабкої кислоти Н2А за температури 298К і розбавленні 63 л/г-екв має еквівалентну електропровідність 7.9 Ом-1см2г-екв-1, а за нескінченного розбавлення вона дорівнює 399.8 Ом-1см2г-екв-1. Розрахуйте константу дисоціації і рН кислоти.
9. Питома електропровідність нескінченно розбавлених розчинів KCl, KNO3 і AgNO3 за температури 25 oC дорівнює відповідно 149.9, 145.0 і 133.4 Ом-1·м-1. Чому дорівнює питома електропровідність нескінченно розбавленого розчину AgCl за 25ОC?
10. Еквівалентні електропровідності нескінченно розбавлених розчинів НСІ, NaCl і CH3COONa за температури 25 0С дорівнюють 425.0 128.1 і 91.0 Ом-1.см2.моль-1 відповідно. Чому дорівнює еквівалентна електропровідність оцтової кислоти (CH3COOН) за нескінченного розбавлення і температури 250С?
11.Еквівалентні електропровідності нескінченно розбавлених розчинів КСІ, KNO3 i AgNO3 за температури 250С дорівнюють, відповідно, 149.9, 145.0 і 133.4 Ом-1.см2.моль-1.Чому дорівнює еквівалентна електропровідність нескінченно розбавленого розчину AgСІ за температури 250С ?
12.Яку частку загальної кількості зарядів переносить іон Li+ у водному розчині LiBr за температури 250С, якщо рухливості Li+ і Br¯ дорівнюють відповідно 6.87 і 7.81 Ом-1.см2.моль-1?
13. Розрахуйте питому і еквівалентну електропровідності 0.01н розчину КСІ, якщо питомий опір розчину становить ρ = 709.22 Ом·см.
14. Еквівалентна електропровідність розчину електроліту за 298К дорівнює:
| С·103, моль/л | 0.1 | 0.05 | 0.03 | 0.01 | l∞ |
| l,Ом-1см2г-екв-1 | 193.9 | 282.6 | 347.0 | 386.1 | 399.8 |
Розрахуйте середнє значення константи дисоціації для електролітів: а) НА; б) Н2А; в) Н3А; г) Н2А3..
15.Еквівалентна електропровідність 1.59.10-4 моль/л розчину оцтової кислоти за температури 250С дорівнює 12.77 Ом-1.см2 .моль-1. Розрахуйте константу дисоціації кислоти і рН розчину.
16. Еквівалентна електропровідність розчину гідроксиду етиламонію C2H5NH3OH за нескінченного розбавлення становить 232.6 Ом-1.см2 . моль-1. Розрахуйте константу дисоціації гідроксиду етиламонію, еквівалентну електропровідність розчину, ступінь дисоціації і концентрацію іонів гідроксилу в розчині за розбавлення V=16 л·моль-1, якщо питома електропровідність за даного розбавлення дорівнює 1.312.10-3 Ом-1 .см-1.
17. Еквівалентна електропровідність AgNO3 за температури 298К і нескінченному розбавленні становить 133.36 Ом-1·см2· моль-1. Число перенесення Ag+ дорівнює 0.464. Розрахуйте рухливості іонів Ag+ і NO3-.
18. Розрахуйте еквівалентну електропровідність за температури 298К і за нескінченного розбавлення для дихлороцтової кислоти (СНСІ2СООН), якщо константа дисоціації дорівнює К=3.32·10-2 моль/м3, а еквівалентна електропровідність за розбавлення V = 32 л/моль становить 69.8 Ом-1см2моль-1.
19. Розрахуйте ступінь дисоціації і рН 1.5·10-4 М розчину СНСІ2СООН, якщо константа дисоціації кислоти дорівнює К = 3.32·10-2.
20. Розрахуйте ступінь дисоціації води за температури 298К якщо питома електропровідність води становить χ = 6.33·10-8 Ом-1·см-1. Рухливості катіону водню і аніону гідроксилу за нескінченного розбавлення дорівнюють: 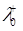 =349.8 Ом-1·см2·моль-1,
=349.8 Ом-1·см2·моль-1, 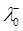 = 198.3 Ом-1·см2·моль-1. Густина води дорівнює ρ=0.997 г/см3.
= 198.3 Ом-1·см2·моль-1. Густина води дорівнює ρ=0.997 г/см3.
21. За температури 298К питома електропровідність масляної кислоти С3Н7СООН з концентрацією 0.016 моль/м3 становить χ = 1.81·10-2 Ом-1·м-1. Еквівалентна електропровідність розчину кислоти за нескінченного розбавлення дорівнює 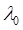 =380·10-4 Ом-1·м2·кмоль-1. Розрахуйте ступінь дисоціації, константу дисоціації та рН розчину кислоти за даних умов.
=380·10-4 Ом-1·м2·кмоль-1. Розрахуйте ступінь дисоціації, константу дисоціації та рН розчину кислоти за даних умов.
22. Абсолютні рухливості іонів Н+ і ОCl- в розбавленому розчині за 291 К дорівнюють відповідно 31.3·10-8 і 6.1·10-8 м2/(с·В). Розрахуйте еквівалентні електропровідності і числа перенесення іонів розчину НОCl.
23. Для нескінченно розбавленого розчину NaCl за температури 298 K число перенесення катіону дорівнює t+=0.382. Розрахуйте еквівалентну електропровідність і абсолютну рухливість аніону СІ-, якщо еквівалентна електропровідність нескінченно розбавленого розчину NaCl становить λ0=0.01265 Ом-1·моль-1·м2.
24. Розрахуйте еквівалентну електропровідність за 298К і за нескінченного розбавлення для водного розчину оцтової кислоти, якщо константа дисоціації К=1.754·10-5, а еквівалентна електропровідність за концентрації с=0.03 моль/л дорівнює 9.58 Ом-1см2 моль-1.
25. Залежність добутку розчинності електроліту типу КА від температури записується рівнянням lnLKA =-A/Т - BlnT - CT + D. Виведіть рівняння залежності теплоти дисоціації електроліту від температури. За якої температури розчинність досягає максимального значення?
26. Залежність іонного добутку води від температури має вигляд:
lnKW =-12073.2/T – 27.24lnT – 0.0196T + 81.513.
Виведіть рівняння залежності теплоти дисоціації від температури. За якої температури іонний добуток води досягає максимального значення?
27. Стандартні електродні потенціали мідного і цинкового електродів відповідно дорівнюють: 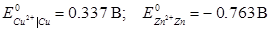 . Розрахуйте ЕРС гальванічного елементу, складеного з електродів Zn2+| Zn (
. Розрахуйте ЕРС гальванічного елементу, складеного з електродів Zn2+| Zn ( 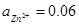 ) i Cu2+| Cu (
) i Cu2+| Cu ( 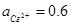 ).
).
28. Стандартні електродні потенціали електродів, на яких відбуваються реакції Fe2+ + 2e = Fe i Fe3+ + e = Fe2+, дорівнюють -0.440 В і +0.771 В відповідно. Розрахуйте стандартний електродний потенціал електроду, на якому відбувається реакція Fe3+ + 3e = Fe.
29. Напишіть рівняння реакцій, що відбуваються в наведених гальванічних елементах:
a) Zn | ZnSO4 || CuSO4 | Cu
b)Сs | СsСI || KCl| AgCl | Ag
c) K | KNO3 || AgNO3 | Ag
d) Ag |AgI |KI || {FeCl3, FeCI2} | Pt
e) Pt | {Cu2+, Cu+} || Cl־ | Cl2 | Pt
30. Запишіть гальванічні елементи в яких відбуваються наступні реакції:
a) Zn + 2Fe3+ = Zn2+ + Fe2+
b) H2 +Cl2 = 2HCl
c) 2Ag+ + H2 = 2Ag + 2H+
d) CuSO4 + Cd = CdSO4 + Cu
31. Запишіть рівняння реакцій , що відбуваються в наведених гальванічних елементах, та розрахуйте для них константи рівноваги за температури 298К:
1) Zn|ZnSO4||AgNO3|Ag
2) Pt|{Sn4+;Sn2+}||{Fe3+;Fe2+}|Pt
Стандартні електродні потенціали за даної температури дорівнюють:
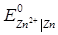 = -0.763 В;
= -0.763 В; 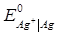 = 0.799 В;
= 0.799 В; 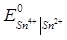 = 0.15 В;
= 0.15 В; 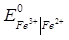 = 0.771 В.
= 0.771 В.
32. Розрахуйте рН розчину, якщо за температури Т = 298 К ЕРС елементу
Pt | Hg | Hg2Cl2| KCl || H+, хінгідрон| Pt
становить 0.15 В. Стандартний електродний потенціал хінгідронного електроду дорівнює + 0.6994 В, каломельного + 0.3341 В.
33. Електрорушійна сила елементу ( 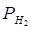 = 1 атм,
= 1 атм, 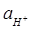 =1, [КСІ] = 0.1 М.)
=1, [КСІ] = 0.1 М.)
Pt | H2|H+|| KCl | Hg2Cl2 | Hg |Pt
дорівнює 0.4 В за температури 298 К. Розрахуйте рН розчину кислоти, якщо електродний потенціал каломельного електроду становить 0.3341 В.
34. ЕРС гальванічного елементу Zn|ZnСІ2;Hg2СІ2|Hg за 298 К дорівнює 1.23В. Концентрація ZnСІ2 в розчині дорівнює 0.52М. Розрахуйте середній іонний коефіцієнт активності ZnСІ2 в даному розчині за 298 К. Величини стандартних електродних потенціалів знайдіть у довіднику.
35. ЕРС гальванічного елементу Cd|CdCl2;PbCl2|Pb за 298 К дорівнює 0.277В, а температурний коефіцієнт становить -4.8·10-4В/К.Напишіть рівняння реакції, що відбувається в цьому елементі, і розрахуйте DS, DG і DH для цієї реакції за 298 К.
36. Під яким тиском поступає хлор в лівий електрод, якщо ЕРС елементу
Pt½ СІ2 ½ HCl, aq ½ СІ2 ½ Pt
PСІ 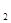 =? 0.01М PСІ
=? 0.01М PСІ 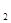 =1атм.
=1атм.
за температури 298 К дорівнює 0.0059В.
37. Яким чином повинен бути складений гальванічний елемент в якому відбувається реакція
Ag+ + Cl- = AgCl.
38. Чи можливе протікання за стандартних умов реакції Fe3+ + Ag = Ag+ + Fe2+ (Т=298 К), якщо стандартні електродні потенціали дорівнюють:
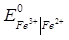 = 0.771В,
= 0.771В, 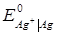 =0.799 В.
=0.799 В.
39. Розрахуйте стандартний електродний потенціал електроду Ag½Agl½Kl за 298К, якщо при цій температурі добуток розчинності AgI дорівнює 8.3·10-17. Стандартний електродний потенціал срібного електроду 0.799В.
40. Розрахуйте константу рівноваги реакції ZnSO4 + Cd = CdSO4 + Zn за температури 25oC, якщо стандартні електродні потенціали електродів Zn2+½Zn і Cd2+½Cd відповідно дорівнюють -0.763 В і -0.403 В.
41. Розрахуйте константу рівноваги реакції ZnSO4 + Cd = CdSO4 + Zn за температури 250С по даних про стандартні електродні потенціали.
42. По значеннях стандартних електродних потенціалів за температури 298 К розрахуйте константу рівноваги реакції:
CuSO4 + Sn = SnSO4 + Cu
43. По значеннях стандартних електродних потенціалів визначить ймовірність протікання реакції Mn + Fe3+ = Fe2+ + Mn 2+.Розрахуйте константу рівноваги реакції за температури 298 К.
44. ЕРС елементу в якому за температури 298 К відбувається реакція 0.5Hg2Cl2 + Ag = AgCl + Hg, дорівнює 0.456В і 0.439В за температури 293 К. Розрахуйте DS, DG і DH реакції.
45. За температури 298К електрорушійна сила елементу Cd(тв)|CdI2|AgI(тв)|Ag дорівнює Е = 0.285 В. Розрахуйте активність CdI2 в розчині.
46. Розрахуйте тепловий ефект реакції Zn + 2AgCl = ZnCl2 + 2Ag, що відбувається у гальванічному елементі за температури 273 К, якщо ЕРС елементу становить E= 1.015 В і температурний коефіцієнт ЕРС дорівнює
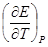 =-4.02·10-4 В/K.
=-4.02·10-4 В/K.
47. Електрорушійна сила елементу
Ag½AgСІ ½ HCl, aq ½ Hg2СІ2½ Hg
дорівнює Е = 0.046 В, температурний коефіцієнт ЕРС за температури 298 К становить 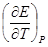 =3.38·10-4В/К. Розрахуйте зміну ізобарно-ізотермічного потенціалу, ентропії і ентальпії реакції, що відбувається в елементі.
=3.38·10-4В/К. Розрахуйте зміну ізобарно-ізотермічного потенціалу, ентропії і ентальпії реакції, що відбувається в елементі.
48. ЕРС елементу Pt½H2½HCl½AgCl½Ag за температури 25 0С дорівнює 0.322 В. Чому дорівнює рН розчину НСІ?
49. Залежність ЕРС від температури для елементу, в якому протікає реакція
Zn + Hg2SO4 = Zn SO4 + 2Hg
має вигляд: Е = 1.4328 – 0.0011(Т – 298) - 7·10-6(Т – 298)2.
Розрахуйте значення ΔG, ΔS, іΔH реакції за температури 303 К.
50. В гальванічному елементі за температури 298 К оборотно протікає реакція Cd+2AgCl=CdCl2+2Ag. Розрахуйте зміну ентропії, якщо стандартна ЕРС елементу становить Eo= 0.6753 В, а стандартні ентальпії утворення CdCl2 і AgCl дорівнюють -389.7 і -126.9 кДж./моль відповідно.
51. Три гальванічні елементи мають стандартні ЕРС за температури 298К 0.01, 0.1 і 1.0 В відповідно. Розрахуйте константи рівноваги реакцій, що відбуваються в елементах, якщо кількість електронів, що приймають участь в елементарних окисно-відновних реакціях елементів, n = 1.
52.ЕРСелементу, в якому оборотно відбувається реакція 0.5Hg2Cl2+Ag=AgCl+Hg, дорівнює 0.456 В за температури 298К і 0.439 за температури 293К. Розрахуйте ΔG, ΔS, іΔH реакції за температури 300 К.
53. Розрахуйте константу рівноваги реакції Cd + Cu2+ = Cu + Cd2+, якщо стандартні потенціали мідного і кадмієвого електродів дорівнюють: 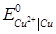 =+0.337В,
=+0.337В, 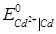 = - 0.403В.
= - 0.403В.
54. Розрахуйте тепловий ефект реакції Zn + 2AgCl = ZnCl2 + 2Ag , що відбувається в гальванічному елементі за температури 273 К, якщо ЕРС елементу дорівнює 1.015В, а температурний коефіцієнт - -4.02·10-4 В/К.
55. В гальванічному елементі за температури 298К оборотньо протікає реакція Cd+2AgCl=CdCl2+2Ag. Розрахуйте зміну ентропії реакції, якщо стандартна ЕРС елементу Е0 = 0.6753В, а стандартні ентальпії утворення CdCl2 i AgCl дорівнюють -389.7 і -126.9 кДж/моль відповідно.
56. ЕРС елементу, в якому відбувається реакція H2 + 2AgBr = 2HBr + 2Ag, змінюється з температурою згідно рівнянню:
Е = 0.07131 – 4.99·10-4(Т – 298) – 3.45·10-6(Т – 298)2
Розрахуйте для даної реакції,ΔU за температури 308 К.
57. Для елементу Pt|{A;B}|| {C;D}| Pt за температури 298 К по довідникових даних про стандартні електродні потенціали і активності реагентів запишіть рівняння, що відбувається в гальванічному елементі і розрахуйте електрорушійну силу елементу, енергію Гіббса і константу рівноваги окисно-відновної реакції:
| № | А | В | С | D | aA | aB | aC | aD |
| Tl3+ | Tl+ | Cr3+ | Cr2+ | 0.002 | 0.1 | 0.06 | 0.02 | |
| Sn4+ | Sn2+ | Ce4+ | Ce3+ | 0.03 | 0.001 | 0.02 | 0.05 | |
| Fe3+ | Fe2+ | Co3+ | Co2+ | 0.01 | 0.03 | 0.1 | 0.05 | |
| V3+ | V2+ | Pu4+ | Pu3+ | 0.02 | 0.05 | 0.6 | 0.02 | |
| UO22+ | UO2+ | S2O82- | SO42- | 0.1 | 0.5 | 0.03 | 0.08 |
58. Для реакції, що відбувається оборотньо в гальванічному елементі, дається рівняння залежності електрорушійної сили Е від температури. За заданої температури Т розрахуйте електрорушійну силу елементу (Е), зміну енергії Гіббса (ΔG), ентальпії (ΔH), ентропії (ΔS), енергії Гельмгольця (ΔA) і теплоту (Q), що виділяється, чи поглинається при роботі елементу. Розрахунки проводити для 1 моля реагуючої речовини.
| № | Т,К | Реакція | Рівняння Е = f(T) |
| Pb+PbO2+2H2SO4=2PbSO4+2H2O | E = 2.1191 + 1.62·10-4(T-273) + + 8.5·10-7(T-273)2 | ||
| Hg2SO4+Cd= CdSO4+2Hg | E = 1.0183-4.06·10-5(T-298) | ||
| 2AgI+Pb=2Ag+PbI2 | E=0.259-1.38·10-4T | ||
| Hg2Cl2+Pb=2Hg+PbCl2 | E=0.5353+1.45·10-4T | ||
| ZnCl2+2Hg=Hg2Cl2+Zn | E=1.0045+9.4·10-5(T-298) | ||
| 2Hg+2Cl-=Hg2Cl2+2e | E=0.2415-6.5·10-4(T-298) |
59. В гальванічному елементі протікає реакція CuSO4 + Zn = ZnSO4 + Cu. Розрахуйте ΔH і ΔS реакції, якщо ЕРС елементу дорівнює 1.960 В і 1.961 В за температур 273 К і 276 К відповідно.
60. В елементі Вестона відбувається реакція Cd + Hg2SO4 = Cd2+ + 2Hg. Розрахуйте ЕРС цього елементу за температури 303 К, якщо ΔH і ΔS реакції дорівнюють -198.8 кДж/моль и -7.8 Дж/(моль∙K)
61. Тепловий ефект реакції Pb + 2AgCl = PbCl2 + 2Ag, що відбувається у гальванічному елементі, дорівнює ΔH = -105.1 кДж/моль. За температури 298.2К ЕРС елементу дорівнює 0.4901 В. Розрахуйте ЕРС елементу за температури 293.2К.
| <== попередня сторінка | | | наступна сторінка ==> |
| Вихідні дані | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |