
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Методические указания
Міцела
Тут [nAgI] – кількість молекул AgI, яка міститься в агрегаті (ядрі); mI- - кількість потенціалвизначаючих іонів; (m-x)K+ - кількість протиіонів у твердому адсорбційному подвійному шарі ; xK+ - кількість протиіонів, які містяться у дифузному шарі.
У колоїдній хімії прийнята така форма запису будови міцели:
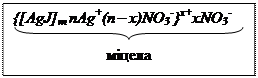
Умовні позначення:
m – кількість молекул в ядрі частинки (ядро зображене у квадратних дужках);
n – кількість йонів, які міцно адсорбовані на поверхні ядра. Вони називаються потенціал-визначаючими йонами;
х – кількість протийонів, які утворюють зовнішній, дифузний шар;
(n – х) – частина протийонів, які входять до адсорбційного шару і до складу гранули(вона зображена у фігурних дужках).
Таким чином, міцела в цілому електронейтральна. А гранула має заряд, який залежить від того, яка з реагуючих речовин взята з надлишком. Якщо у надлишку буде KJ, на ядрі будуть адсорбуватися йони J–, і гранула набуде негативного заряду (рис. 5.4 – а). Якщо в надлишку AgNO3 – гранула набуде позитивного заряду внаслідок адсорбції йонів Ag+ .
СТІЙКІСТЬ І КОАГУЛЯЦІЯ ДИСПЕРСНИХ СИСТЕМ
Проблема стійкості дисперсних систем і факторів, що її викликають, є головною в колоїдній хімії.
Стійкість або нестійкість гетерогенних колоїдних систем залежить від того, що сильніше: або сили зчеплення (притягання, або атракційні сили), під впливом яких відбувається злипання часточок і спостерігається процес осадження – седиментація, або сили відштовхування, які перешкоджають зближенню часточок і їх з’єднанню. Сили притягання мають характер молекулярної взаємодії (вандерваальсові сили). Сили відштовхування визна-чаються електростатичною взаємодією між іонами ПЕШ, які оточують кожну колоїдну частинку і перешкоджають випадінню дисперсної фази в осад.
Розрізняють кінетичну (седиментаційну), термодинамічну і агрегативну стійкість.
Кінетична (седиментаційна) стійкість – здатність дисперсних частинок перебувати у завислому стані і не седиментуватися, тобто не осідати. У дисперсних системах, як і в природних розчинах, існує броунівський рух, що супроводжується дифузним вирівнюванням концентрації частинок у всьому об’ємі золю. Тонкодисперсні системи (золі), часточки яких практично не осідають під впливом сили тяжіння, називаються кінетично (седиментаційно) стійкими. До них належать гідрофільні золі – розчини полімерів, білків тощо. Гідрофобні золі, грубодисперсні системи (суспензії, емульсії) принципово кінетично нестійкі. В них достатньо швидко проходить розподіл фази та середовища.
Агрегатна стійкість –це здатність колоїдних часток зберігати ступінь дисперсності, тобто не злипатись і не утворювати агрегати під впливом різних чинників. Причини агрегативної стійкості колоїдних систем наступні:
1) електростатичне відштовхування однойменних заряджених колоїдних часток;
2) сили не електростатичного характеру, які пов’язані з наявністю на поверхні часток сольватних оболонок, що складаються з молекул дисперсійного середовища;
3) розклинююча дія середовища.
Коагуляція – процес злипання колоїдних часточок перебігає порівняно легко під дією самих різних факторів: введення електролітів, неелектролітів, заморожування, кип’ятіння, перемішування, дії сонячного світла тощо. У процесі електролітної коагуляції часто спостерігається іонообмінна адсорбція: іони коагулянта з більшою валентністю або більшим адсорбційним потенціалом витісняють протиіони спочатку дифузного шару, а потім і адсорбційного шару. Обмін проходить в еквівалентній кількості, але заміна протиіонів приводить до того, що при достатній концентрації електролітів у дисперсному середовищі часточки гублять стійкість і при зіткненні злипаються.
| <== попередня сторінка | | | наступна сторінка ==> |
| Міцелярна теорія будови колоїдних частинок | | | Основи масопереносу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |