
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Закон Гесса
Закон Гесса доводить, що якщо із даних вихідних речовин можна різними шляхами отримати задані кінцеві продукти, то незалежно від шляху одержання, тобто від кількості та виду проміжних реакцій, сумарний тепловий ефект для всіх шляхів буде той самий.
Іншими словами, тепловий ефект хімічної реакції залежить тільки від виду та стану вихідних речовин та продуктів реакції і не залежить від шляху переходу.
Перевіримо зміст закону Гесса на прикладах. Оскільки найчастіше хімічні реакції проходять при постійному тиску, будемо їх тепловий ефект характеризувати зміною ентальпії DН. Уявимо процес перетворення вихідних речовин А1, А2, А3… у продукти В1, В2, В3…, причому це перетворення може бути здійснено різними шляхами:
1 Прямою реакцією перетворення речовин А у речовини В з тепловим ефектом DН1.
2 Реакцією, яка складається з двох стадій з тепловими ефектами DН2 і DН3.
3 Сукупністю реакцій з тепловими ефектами DН4, DН5, DН6, DН7.

Рисунок 2.1 – Ілюстрація закону Гесса
Закон Гесса стверджує, що ці теплові ефекти зв’язані між собою співвідношенням:
DН1 = DН2 + DН3 = DН4 + DН5 + DН6 + DН7.
Практичне значення закону Гесса складається з того, що він дозволяє обчислити теплові ефекти таких реакцій, для яких вони безпосередньо не можуть бути виміряні. Наприклад, тепловий ефект DНХ реакції С+1/2О2=СО неможливо обчислити безпосереднім вимірюванням, оскільки одночасно з цією реакцією завжди проходить реакція утворення СО2. Для визначення DНХ використовуємо теплові ефекти таких реакцій:
СО + ½ О2 = СО2, DН1 = -284,0 кДж/моль,
С + О2 = СО2, DН2 = -394,0 кДж/моль.
Відповідно до закону Гесса DН2=DН1+DНХ або DНХ=DН2-DН1=-394,0–(-284,0)=-110,0 кДж/моль.
Теплові ефекти хімічних реакції можуть бути виміряні і експериментально спеціальними приладами, які називаються калориметрами. Точні калориметричні вимірювання достатньо трудомісткі та потребують багато часу. Тому їх проводять тільки у випадках неможливості використовування закону Гесса.
При написанні термохімічних рівнянь зазначають агрегатний стан реагентів та тепловий ефект реакції:
С3Н6О(г) + 4О2(г) = 3СО2(г) + 3Н2О(ж),
DН = - 1817, 0 кДж/моль.
Такий запис означає, що в результаті реакції 1 моль газоподібного ацетону С3Н6О з 4 моль газоподібного кисню одержують 3 моль газоподібного СО2 і 3 моль рідкої води. При цьому виділяється 1817,0 кДж теплоти на 1 моль ацетону.
Оскільки теплові ефекти залежать від фізичного стану речовин, що реагують та умов, за якими проходить реакція, то для виконання термохімічних розрахунків, теплові ефекти, обчислювані в термохімічних рівняннях, повинні бути одержані за будь-яких однакових умов, у противному разі вони не можуть бути порівняні. Тобто за такі умови приймають умови, за яких реакція проходить між речовинами, які перебувають у стандартних станах.
За стандартний стан окремих рідких та твердих речовин беруть їх сталий стан при температурі 298,15 К (250С) та тиску 101325 Па ( 1 атм ), а для газів – такий їх стан, коли при тиску 101325 Па та температурі 298,15 К вони підпорядковуються рівнянню стану ідеального газу. Тому теплові ефекти реакцій за стандартних умов позначають DН0298.
Із закону Гесса випливають висновки, які мають велике практичне значення.
1 Тепловий ефект прямої реакції DН1 дорівнює за величиною та протилежний за знаком тепловому ефекту зворотної реакції DН2, тобто DН1 = - DН2(рис. 2.2 а).
2 Якщо здійснюються дві реакції з різними початковими станами, результатом яких є однаковий кінцевий стан, то різниця між їх тепловими ефектами являє собою тепловий ефект переходу з одного початкового стану в інший(рис.2.2 б).

а б в
Рисунок 2.2 – Ілюстрація першого (а), другого (б) та третього
(в) висновків із закону Гесса
Розглянемо класичний приклад визначення теплового ефекту перетворення графіту в алмаз за стандартних умов шляхом аналізу реакцій їх горіння:
С(графіт) + О2 = СО2, DН = - 393,51 кДж/моль,
С(алмаз) + О2 = СО2, DН = - 395,34 кДж/моль,
 С(графіт)
С(графіт) 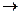 С(алмаз), DН = + 1,83 кДж,моль.
С(алмаз), DН = + 1,83 кДж,моль.
3 Якщо проходять дві реакції, які призводять з одного початкового стану до різних кінцевих станів, то різниця між їх тепловими ефектами є тепловим ефектом переходу із одного кінцевого стану в інший(рис.2.2 в).
Наприклад, реакція горіння водню з утворенням одного моля води:
Н2 + 1/2О2 = Н2О(г), DН = - 241,83 кДж/моль,
Н2 + 1/2О2 = Н2О(р), DН = - 285,84 кДж/моль,
Н2 + 1/2О2 = Н2О(т) , DН = - 291,67 кДж/моль.
Отже,
Н2О(т) à Н2О(р), DН = + 5,83 кДж/моль,
Н2О(р) à Н2О(т), DН = + 44,01 кДж/моль,
Н2О(т) à Н2О(г), DН = + 49,84 кДж/моль.
Ми отримуємо значення ентальпій плавлення, випарювання та сублімації води.
2.3 Термохімічні розрахунки
Закон Гесса дозволяє обчислити теплові ефекти процесів, для яких відсутні експериментальні дані. Це стосується не тільки хімічних реакцій, але й процесів розчинення, випарювання, сублімації, кристалізації та ін. При термохімічних розрахунках особливо значимі два види теплових ефектів: ентальпія утворення та ентальпія згоряння сполук.
Ентальпія утворення сполуки є тепловим ефектом реакції утворення одного моля даної сполуки із простих речовин за стандартних умов. Наприклад, стандартна ентальпія утворення DfН карбонату кальцію – це тепловий ефект реакції
Са(т) + С(графіт) + 1,5О2(г) = СаСО3(т), DfН0298 = - 1206 кДж.
При цьому ентальпія утворення простих речовин (Н2, О2, Са, С та ін.) дорівнює нулю, а ентальпії утворення більшості відомих речовин можна відшукати у довідниках.
За значною кількістю стандартних ентальпій утворення можна обчислити теплові ефекти багатьох хімічних реакцій. При цьому використовують правило, яке випливає із закону Гесса:
тепловий ефект хімічної реакції дорівнює різниці суми ентальпій утворювання кінцевих речовин та суми ентальпій утворювання вихідних речовин із урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Нехай хімічна реакція проходить відповідно до рівняння
аА + bВ = сС + dD DН - ?
Тут а, b, с, d –коефіцієнти перед речовинами А, В, С, D. Тоді
DН = (сDfНС + dDfНD) – ( aDfНA + bDfНB)(2.4)
Для наочності розглянемо конкретний приклад. Реакція горіння етану С2Н6 описується рівнянням
С2Н6(г) + 3,5О2(г) = 2СО2(г)+3Н2О(ж),
DН298 =-1559,87 кДж/моль.
Обчислити ентальпію утворення етану, якщо відомі ентальпії утворення вуглекислого газу та води:
DfН298(СО2)=-393,51кДж/моль, DfН298(Н2О)=-285,84кДж/моль (табл.. 2.1).
Відповідно до закону Гесса маємо:
DН298 = 2DfН(СО2) + 3DfН(Н2О) - DfН(С2Н6).
Звідси DfН298(С2Н6) = 2DfН298(СО2) + 3DfН298(Н2О) - DН298 =
=2(-393,51) + 3(-285,84) – ( - 1559,87) = -84,67 кДж/моль.
Ентальпія згоряння сполукице тепловий ефект реакції окислення даної сполуки киснем за стандартних умов з утворенням вищих оксидів елементів, що входять до складу цієї сполуки. Наприклад, стандартна ентальпія згоряння DСН етилового спирту – це тепловий ефект реакції
С2Н5ОН(ж) + 3О2 = 2СО2(г) + 3Н2О(ж).
Продуктами згоряння є СО2, Н2О(г) або Н2О(ж), SO3 та інші. Якщо серед продуктів реакції крім оксидів, наявні інші речовини (наприклад, N2, HCl), то це спеціально обумовлюється. Ентальпії згоряння вищих оксидів та інших продуктів згоряння, а також кисню брати за нуль. За допомогою ентальпій згоряння можна також розрахувати теплові ефекти хімічних реакцій, використовуючи таке правило:
тепловий ефект хімічної реакції дорівнює різниці суми ентальпій згоряння вихідних речовин та сумі ентальпій згоряння продуктів реакції з урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Для наведеної в даному розділі абстрактної реакції
DН = (аDСНА + вDСНВ)-(сDСНС + dDСНD). (2.5)
Розрахуємо тепловий ефект реакції етерифікації щавлевої кислоти метиловим спиртом, яка проходить за стандартних умов
(СООН)2(т) + 2СН3ОН(ж) = (СООСН3)2(ж) + 2Н2О(ж).
У довіднику відшуковуємо значення стандартних ентальпій згоряння речовин:
DСН[(СООН)2]= -251,8 кДж/моль,
DСН[(СН3ОН)] = -727,6 кДж/моль,
DСН[(СООСН3)2] = -1680,2 кДж/моль,
DСН(Н2О) = 0.
Звідси DН298 = -251,8 + 2(-727,6) – (-1680,2) = -26,8 кДж/моль.
2.4. Залежність теплового ефекту реакції від
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- IV. Закони ідеальних газів.
- IV. Закономірності структурно-функціональної організації спинного мозку
- Авілум – “син чоловіка” – повноправна людина, охороні його життя, здоров’я, захисту його майнових інтересів присвячена значна частина законника.
- Аграрне право та законодавство США, Німеччини, Франції, Великої Британії, Ізраїлю, Польщі, Росії
- Аграрні закони України
- Адаптація законодавства України до законодавства ЄС - один із важливих інструментів створення в Україні нової правової системи та громадянського суспільства
- Адаптація законодавства України до законодавства ЄС - один із важливих інструментів створення в Україні нової правової системи та громадянського суспільства
- Адміністративна відповідальність за порушення аграрного законодавства
- Адміністративна відповідальність за порушення земельного законодавства
- Адміністративна відповідальність за порушення податкового законодавства.
- Адміністративна відповідальність осіб, винних в порушенні податкового законодавства
| <== попередня сторінка | | | наступна сторінка ==> |
| Питання | | | Температури |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |