
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Температури
Розглянемо хімічну реакцію
n N + m M = k K + d D
Тепловий ефект цієї реакції при постійному тиску DН дорівнює різниці ентальпій утворення продуктів реакції та вихідних речовин:
DН = [k DН(K) + d DН(D)] - [n DН(N) + m DН(M)]. (2.6)
Диференціюючи цю рівність за температурою Т, отримуємо:
 (2.7)
(2.7)
Враховуючи, що ¶Н/¶Т = СР, маємо
(¶DН/¶Т)Р =[k CP(K) + d CP(D)] - [n CP(N) + m CP(M)]. (2.9)
Позначаючи DСР різницю теплоємностей кінцевих та вихідних речовин, що мають відповідні коефіцієнти, отримуємо
(¶DН/¶Т)Р = DСР.(2.10)
Розглядаючи реакцію, що проходить при постійному об¢ємі , можна аналогічним способом отримати
(¶DU/¶T)V = DCV. (2.11)
Знайдені співвідношення являють собою рівняння Кірхгофа у диференціальному вигляді. Розв’яжемо перше з цих рівнянь (розв’язок обох рівнянь однаковий). Розділяємо змінні й інтегруємо за температурою
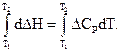 (2.12)
(2.12)
Отримуємо  або
або
 (2.13)
(2.13)
Для розрахунку 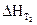 – теплового ефекту при температурі Т2 – треба знати
– теплового ефекту при температурі Т2 – треба знати  та мати дані про теплоємності всіх учасників реакції в інтервалі температур від Т1 до Т2.
та мати дані про теплоємності всіх учасників реакції в інтервалі температур від Т1 до Т2.
За температуру Т1 зручно взяти температуру 298К, оскільки для цієї температури є велика кількість довідкових даних. У цьому випадку можна записати
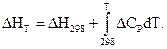 (2.14)
(2.14)
Отримане в інтегральному вигляді рівняння Кірхгофа дозволяє розраховувати теплові ефекти реакцій при різних температурах. Залежно від того, які дані про теплоємності є у довідковій літературі, отримане рівняння застосовують, використовуючи три наближення.
Упершому, найгрубішому наближенні, припускають, що DСР = 0. У цьому випадку виявляється, що DНТ = DН298, тобто тепловий ефект від температури не залежить.
Удругому, більш точному наближенні, вважають що, різниця теплоємностей є постійна величин - DСР = const. Тому отримують
DНТ = DН298 + DСp(Т – 298). (2.15)
Утретьому, найточнішому наближенні, враховують залежність теплоємностей від температури. Як уже зазначалося у даному курсі найточніше залежність теплоємності від температури можна описати ступеневою функцією типу
СР = а + вТ + сТ2 + с¢/Т2. Якщо відомі коефіцієнти цього рівняння для всіх учасників реакції, то
DСР = Dа + DвТ + DсТ2 + Dс¢/Т2 (2.16)
де
Dа = [k∙a(K)+ d∙a(D)] - [n∙a(N) + m∙a(M)]. (2.17)
Аналогічно розраховуються Dв, Dс та Dс¢. Розв’язок рівняння Кірхгофа приводить у цьому випадку до співвідношення
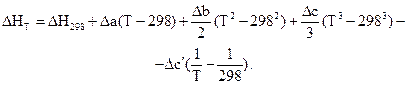
(2.18)
Для термохімічних розрахунків необхідні табличні данні. У табл. 2.1 наведені деякі термодинамічні властивості невеликої кількості хімічних речовин.
Таблиця 2.1 – Термодинамічні властивості речовин
| Вещество | DН0298, кДж/моль | S0298, Дж/мольК | Cp0298, Дж/мольК | Cp = f(T), Дж/мольК | |||
| а | b×103 | c`×10-5 | c×106 | ||||
| Br2(р) | 152,21 | 75,69 | 75,69 | ||||
| Br2(г) | 30,91 | 245,37 | 36,07 | 37,32 | 0,50 | -1,26 | |
| C(алмаз) | 1,83 | 2,37 | 6,11 | 9,12 | 13,22 | -6,19 | |
| C(графит) | 5,74 | 8,54 | 16,86 | 4,77 | -8,54 | ||
| Cl2(г) | 222,98 | 33,93 | 37,03 | 0,67 | -2,85 | ||
| H2(г) | 130,52 | 28,83 | 27,28 | 3,26 | 0,50 | ||
| N2(г) | 191,50 | 29,12 | 27,88 | 4,27 | |||
| O2(г) | 205,04 | 29,37 | 31,46 | 3,39 | -3,77 | ||
| S(монокл) | 0,38 | 32,55 | 23,64 | 23,64 | |||
| S(ромбич) | 31,92 | 22,68 | 22,68 | ||||
| S2(г) | 128,37 | 228,03 | 32,51 | 36,11 | 1,09 | -3,51 | |
| CO(г) | -110,53 | 197,55 | 29,14 | 28,41 | 4,10 | -0,46 | |
| CO2(г) | -393,51 | 213,66 | 37,11 | 44,14 | 9,04 | -8,54 | |
| COCl2(г) | -219,50 | 283,64 | 57,76 | 67,15 | 12,03 | -9,04 | |
| CaCO3(т) | -1206,83 | 91,71 | 83,47 | 104,52 | 21,92 | -25,94 | |
| CaO(т) | -635,09 | 38,07 | 42,05 | 49,62 | 4,52 | -6,95 | |
| Ca(OH)2(г) | -985,12 | 83,39 | 87,49 | 105,19 | 12,01 | -19,00 | |
| HCl(г) | -92,31 | 186,79 | 29,14 | 26,53 | 4,60 | 1,09 | |
| H2O(т) | -291,85 | 39,33 | 4,41 | 109,50 | 46,47 | ||
| H2O(р) | -285,83 | 69,95 | 75,30 | 39,02 | 76,64 | 11,96 | |
| H2O(г) | -241,81 | 188,72 | 33,61 | 30,00 | 10,71 | 0,33 | |
| MgO(т) | -601,49 | 27,07 | 37,20 | 48,98 | 3,14 | -11,44 | |
| Mg(OH)2 (т) | -924,66 | 63,18 | 76,99 | 46,99 | 102,85 | ||
| NH3(г) | –45,94 | 192,66 | 35,16 | 29,80 | 25,48 | -1,67 | |
| NH4Cl(т) | –314,22 | 95,81 | 84,10 | ||||
| NO(г) | 91,26 | 210,64 | 29,86 | 29,58 | 3,85 | –0,59 | |
| NOCl(г) | 52,59 | 263,50 | 39,37 | 44,89 | 7,70 | –6,95 | |
| NO2(г) | 34,19 | 240,06 | 36,66 | 41,16 | 11,33 | –7,02 | |
| N2O4(г) | 11,11 | 304,35 | 79,16 | 83,89 | 39,75 | –14,90 | |
| SO2(г) | –296,90 | 248,07 | 39,87 | 46,19 | 7,87 | –7,70 | |
| SO2Cl2(г) | –363,17 | 311,29 | 77,40 | 87,91 | 16,15 | –14,23 | |
| SO3(г) | –395,85 | 256,69 | 50,09 | 64,98 | 11,75 | –16,37 | |
| CH4(г) | –74,85 | 186,27 | 35,71 | 14,32 | 74,66 | –17,43 | |
| C2H4(г) | 52,30 | 219,45 | 43,56 | 11,32 | 122,01 | –37,90 | |
| C2H6(г) | –84,67 | 229,49 | 52,64 | 5,75 | 175,11 | –57,85 | |
| C6H6(г) | 82,93 | 269,20 | 81,67 | -21,09 | 400,12 | -169,87 | |
| C6H12(г) | -123,14 | 298,24 | 106,27 | -51,71 | 598,77 | -230,00 | |
| CH3OH(г) | –201,00 | 239,76 | 44,13 | 15,28 | 105,20 | –31,04 | |
| CH3CHO(г) | –166,00 | 264,20 | 54,64 | 13,00 | 153,50 | –53,70 | |
| C2H5OH(г) | –234,80 | 281,38 | 65,75 | 10,99 | 204,70 | –74,20 | |
| C2H5OH(р) | –276,98 | 160,67 | 111,96 |
Розрахунки за формулою 2.18 розглянемо на прикладі реакції С6Н6(г) + 3 Н2 = С6Н12(г) для Т=800К.
Спочатку обчислимо ΔНо298. Для проведення розрахунку необхідно взяти в табл. 2.1 ентальпії утворення всіх речовин та підставити їх у формулу 2.4.
ΔНо298= ΔfHo298(C6H12) – [ΔfHo298(C6H6) + 3ΔfHo298(H2)] =
= - 123,14–(82,93+3·0) = -206,07 КДж/моль = -206070 Дж/моль.
Інтегральне рівняння Кірхгофа для температури 800 К має вигляд:
ΔН800 = ΔНо298 + Δа(800 – 298) + Δв/2(8002-2982) +
+ Δс/3(8003-2983) – Δс’(1/800 – 1/298).
Δа, Δв, Δс и Δс’ необхідно розраховувати по закону Гесса, т. б. з значення відповідної велечини для продукту реакції потрібно відняти значення цієї велечини для вихідної речовини. Данні для такого розрахунку необхідно брати в табл.2.1 Наприклад, розрахунок Δа проводять так:
Δа = а(С6Н12) + [а(С6Н6) + 3 а(Н2)] =
=-51,71 – [-21,09 + 3·27,28] =-112,46 Дж/мольК.
При розрахунку Δв, Δс, Δс’ зверніть увагу, що в табл.2.1 значення в, с и с’ помножені на величину 10-х (10+х ). Дійсні же значення цих величин повинні бути помножені на 10+х(10-х).
Результати розрахунків:
| Δа | Δв | Δс' | Δc | ΔН800, Дж/моль |
| -112,46 | 188,87∙10-3 | -1,50∙105 | -60,13∙10-6 | -220520 |
Висновки
Закон Гесса дозволяє розраховувати теплові ефекти хімічних реакцій для стандартних умов. Частіше за все такі розрахунки проводять з використанням табличних значень ентальпії утворення речовин.
Розрахунки ентальпії реакцій для нестандартних температур проводять з використанням рівняння Кірхгофа.
СТИСЛИЙ конспект лекцІй
Тепловим ефектом хімічної реакціїназивається кількість теплоти, яка виділяється (екзотермічні реакції) або поглинається (ендотермічні реакції) при незворотному проходженні реакції, коли єдиною роботою є тільки робота розширення.
Тепловий ефект хімічної реакції, яка проходить при постійному об¢ємі, називається ізохорним тепловим ефектом та позначається QV.
QV = U2 - U1 = DU
Ізобарний тепловий ефект реакції(QP) дорівнює
QP = ΔH.
Закон Гессадоводить, що якщо із даних вихідних речовин можна різними шляхами отримати задані кінцеві продукти, то незалежно від шляху одержання, тобто від кількості та виду проміжних реакцій, сумарний тепловий ефект для всіх шляхів буде той самий.
Іншими словами, тепловий ефект хімічної реакції залежить тільки від виду та стану вихідних речовин та продуктів реакції і не залежить від шляху переходу.
За стандартний стан окремих рідких та твердих речовин беруть їх сталий стан при температурі 298,15 К (250С) та тиску 101325 Па, а для газів – такий їх стан, коли при тиску 101325 Па та температурі 298,15 К вони підпорядковуються рівнянню стану ідеального газу. Тому теплові ефекти реакцій за стандартних умов позначають DН0298.
Із закону Гесса випливають висновки, які мають велике практичне значення.
1 Тепловий ефект прямої реакції DН1 дорівнює за величиною та протилежний за знаком тепловому ефекту зворотної реакції DН2, тобто DН1 = - DН2 .
2 Якщо здійснюються дві реакції з різними початковими станами, результатом яких є однаковий кінцевий стан, то різниця між їх тепловими ефектами являє собою тепловий ефект переходу з одного початкового стану в інший.
3 Якщо проходять дві реакції, які призводять з одного початкового стану до різних кінцевих станів, то різниця між їх тепловими ефектами є тепловим ефектом переходу із одного кінцевого стану в інший.
Закон Гесса дозволяє обчислити теплові ефекти процесів, для яких відсутні експериментальні дані. Це стосується не тільки хімічних реакцій, але й процесів розчинення, випарювання, сублімації, кристалізації та ін. При термохімічних розрахунках особливо значимі два види теплових ефектів: ентальпія утворення та ентальпія згоряння сполук.
Ентальпія утворення сполук є тепловим ефектом реакції утворення одного моля даної сполуки із простих речовин за стандартних умов.
За значною кількістю стандартних ентальпій утворення можна обчислити теплові ефекти багатьох хімічних реакцій. При цьому використовують правило, яке випливає із закону Гесса:
тепловий ефект хімічної реакції дорівнює різниці суми ентальпій утворювання кінцевих речовин та суми ентальпій утворювання вихідних речовин із урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Нехай хімічна реакція проходить відповідно до рівняння
аА + bВ = сС + dD DН - ?
Тут а, b, с, d –коефіцієнти перед речовинами А, В, С, D. Тоді
DН = (сDfНС + dDfНD) – ( aDfНA + bDfНB).
Ентальпією згоряння сполукиназивають тепловий ефект реакції окислення даної сполуки киснем за стандартних умов з утворенням вищих оксидів елементів, що входять до складу цієї сполуки.
За допомогою ентальпій згоряння можна також розрахувати теплові ефекти хімічних реакцій, використовуючи таке правило:
тепловий ефект хімічної реакції дорівнює різниці суми ентальпій згоряння вихідних речовин та сумі ентальпій згоряння продуктів реакції з урахуванням коефіцієнтів, що подані перед позначенням речовин у рівнянні реакції.
Для наведеної в даному розділі абстрактної реакції
DН = (аDСНА + вDСНВ)-(сDСНС + dDСНD).
Інтегральное рівняння Кірхгофа дозволяє розраховувати теплові ефекти реакцій при різних температурах.
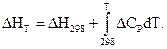
Упершому, найгрубішому наближенні, припускають, що DСР = 0. У цьому випадку виявляється, що DНТ = DН298, тобто тепловий ефект від температури не залежить.
Удругому, більш точному наближенні, вважають що, різниця теплоємностей є постійна величина - DСР = const. Тому отримують
DНТ = DН298 + DСp(Т – 298).
Утретьому, найточнішому наближенні, враховують залежність теплоємностей від температури. Як уже зазначалося у даному курсі найточніше залежність теплоємності від температури можна описати степеневою функцією типу СР = а + вТ+ + сТ2 + с¢/Т2. Якщо відомі коефіцієнти цього рівняння для всіх учасників реакції, то
DСР = Dа + DвТ + DсТ2 + Dс¢/Т2
де
Dа = [k∙a(K)+ d∙a(D)] - [n∙a(N) + m∙a(M)].
Аналогічно розраховуються Dв, Dс та Dс¢. Розв’язок рівняння Кірхгофа приводить у цьому випадку до співвідношення
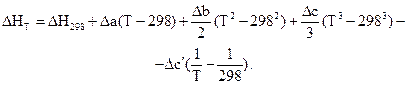
Ключові терміни
Тепловий ефект; закон Гесса; стандартний стан; ентальпія утворення; ентальпія згоряння; рівняння Кірхгофа.
Питання для самоперевірки
1. Що називається тепловим ефектом хімічної реакції?
2. Які два види реакцій розглядаються в термохімії?
3. Які два види теплових ефектів Вам відомі? Чому вони рівні?
4. Сформулюйте закон Гесса.
5. Сформулюйте три слідства із закону Гесса.
6. Дайте визначення стандартним умовам.
7. Як розраховують теплові ефекти реакцій з використанням ентальпій утворення речовин?
8. Як розраховують теплові ефекти реакцій з використанням ентальпій згоряння речовин?
9. Запишіть рівняння, що показує залежність теплоємності речовини від температури.
10. Запишіть інтегральне рівняння Кірхгофа. Перетворіть його для практичного використовування.
Читайте також:
- Алгоритм розрахунку температури поверхні чипу ІМС процесора
- Вертикальний градієнт температури
- Визначення температури на поверхні ізоляції принадземномупрокладанні та при прокладанні трубопроводів в приміщенні.
- Вимірювання температури
- Вимірювання температури контактним методом.
- Вплив всесторонннього стиску і температури на механічні властивості гірських порід
- Вплив температури на рівновагу
- Вплив температури на форму та розмір наночастинок
- Добовий та річний хід температури грунту
- Загальні відомості про вимірювання температури
- Закон Планка. Інтенсивність випромінювання чорного тіла й будь-якого реального тіла залежить від термодинамічної температури й довжини хвилі.
- Залежність опору від температури.
| <== попередня сторінка | | | наступна сторінка ==> |
| Закон Гесса | | | Поняття, ознаки та види суб’єктів господарських правовідносин |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |