
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Циклоалкани
С
С
Ni
С
C
С
C
Ni
С
C
H H
H H
 H׃C ׃ H + · Cl H׃C · + H:Cl
H׃C ׃ H + · Cl H׃C · + H:Cl
· гетеролітичний розрив (іонний):
 А׃В → А+ + : В–
А׃В → А+ + : В–
Утворюються іони.
 Приклади: Н׃Cl → Н+ + : Cl –
Приклади: Н׃Cl → Н+ + : Cl –
 Н׃ОН → Н+ + : ОН–
Н׃ОН → Н+ + : ОН–
Типи реагентів
· радикали –частинки з неспареним електроном (не мають заряда):
Cl · Н3С·
· електрофіли –це позитивні іони та нейтральні частинки, що мають вільну орбіталь:
Н+ NO2+ CH3+
· нуклеофіли –це негативні іони або нейтральні молекули, що мають пару електронів на зовнішньому рівні:
Cl – ОН– Н2О: : NН3
Вуглеводні
· це органічні сполуки, що складаються тільки з атомів С та Н.
Алкани –це вуглеводні з відкритим ланцюгом, в якому між атомами С тільки одинарні зв’язки, а всі інші валентності насичені атомами Н ( насичені вуглеводні, парафіни, гомологічний ряд метану).
Загальна формула СnH2n+2.
Гомологічний ряд алканів:
СН4 метан
С2Н6 етан СН3 – СН3
С3Н8 пропан СН3 – СН2 – СН3
С4Н10 бутан СН3 – СН2 – СН2 – СН3
С5Н12 пентан
С6Н14 гексан
С7Н16 гептан
С8Н18 октан
С9Н20 нонан
С10Н22 декан
Ізомерія –за вуглецевим скелетом:
 CH3 – CH2 – CH2 – СН3 н–бутан
CH3 – CH2 – CH2 – СН3 н–бутан
 С4Н10
С4Н10
СН3 – СН – СН3 2–метилпропан
׀
СН3
 CH3 – CH2 – CH2 – СН2 – СН3 н–пентан
CH3 – CH2 – CH2 – СН2 – СН3 н–пентан


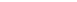 С5Н12 СН3 – СН – СН2 – СН3 2–метилбутан
С5Н12 СН3 – СН – СН2 – СН3 2–метилбутан
׀
СН3
СН3
׀
СН3 – С – СН3 2,2–диметилпропан
׀
СН3
Електронна будова:
· тип гібридизації sp3
· валентний кут 109°28′
· форма молекули тетраедрична
· хімічні зв’язки – одинарні, σ – зв’язки
· довжина зв’язку С – С 0,154 нм
Фізичні властивості: С1 – С4гази
С5 – С15рідини
С16 і більше –тверді
Без кольору та запаху, нерозчинні у воді.

Хімічні властивості етану
1 – горіння:2C2H6 + 7O2 → 4CO2 + 6H2O
1000°С
2 – розклад:C2H6 → 2C + 3H2

– заміщення: hυ
а) галогенування C2H6 + Cl2 → C2H5Cl + HCl
б) нітрування – реакція Коновалова
C2H6 + HNO3 → C2H5NO2 + H2O
4 – каталітичне окислення:
 →CH3 – СН2OH
→CH3 – СН2OH
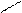
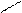 kat O
kat O

 СН3 – СН3 + [O] → СH3 – C
СН3 – СН3 + [O] → СH3 – C
200°CH
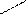
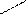 O
O
 → СH3 – C
→ СH3 – C
OH
5 – дегідрогенізація:
СН3 – СН3 → СН2 = СН2 + Н2
Хімічні властивості пропану
1 – горіння:C3H8 + 5O2 → 3CO2 + 4H2O
1000°С
2 – розклад:C3H8 → 3C + 4H2
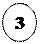
– заміщення: hυ
а) галогенування CH3 – СН2 – СН3 + Cl2 → CH3 – CН – СН3 + HCl
׀
Cl
б) нітрування – реакція Коновалова
CH3 – СН2 – СН3 + HNO3 → CH3 – CН – СН3 + H2O
׀
4 – каталітичне окислення:NO2
 →CH3 – СН2 – CH2OH
→CH3 – СН2 – CH2OH
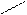
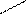 kat O
kat O

 СН3 – CH2 – СН3 + [O] → СH3 – CH2 – C
СН3 – CH2 – СН3 + [O] → СH3 – CH2 – C
200°CH
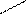
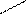 O
O
 → СH3 – CH2 – C
→ СH3 – CH2 – C
5 – дегідрогенізація:OH
СН3 – CH2 – СН3 → СН2 = СН – CH3 + Н2
Ni 600°С
6 – крекінг:С3Н8 → С2Н4 + СН4
Хімічні властивості н–бутану
1 – горіння: 2C4H10 + 13O2 → 8CO2 + 10H2O
1000°С
2 – розклад:C4H10 → 4C + 5H2
– заміщення:
а) галогенування hυ
CH3 – СН2 – СН2 –СН3 + Cl2 → CH3 – CН – СН2 – СН3 + HCl
׀
Cl
б) нітрування – реакція Коновалова
CH3 – СН2 – СН2 –СН3+ HNO3 → CH3 – CН – СН2 – СН3 + H2O
׀
NO2
4 – каталітичне окислення:
 →CH3 – СН2 – CH2 – CH2OH
→CH3 – СН2 – CH2 – CH2OH

 kat O
kat O

 CH3 – СН2 – СН2 –СН3+ [O] → СH3 – CH2 – CH2 – C
CH3 – СН2 – СН2 –СН3+ [O] → СH3 – CH2 – CH2 – C
200°CH
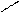 O
O

 → СH3 – CH2 – CH2 – C
→ СH3 – CH2 – CH2 – C
OH
5 – дегідрогенізація:
СН3 – CH2 – CH2 – СН3 → CH3 – СН = СН – CH3 + Н2
|
6 – крекінг:
С4Н10 → С2Н4 + С2Н6
7 – ізомеризація:
AlCl3
СН3 – CH2 – CH2 – СН3 → CH3 – CН – СН3
׀
CH3
Хімічні властивості 2 – метилпропану
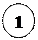 Сl
Сl
– заміщення: hυ׀
а) галогенування CH3 – СН – СН3 + Cl2 → CH3 – C – СН3 + HCl
׀ ׀
СН3 CН3
б) нітрування – реакція КоноваловаNO2
140°C׀
CH3 – СН – СН3 + HNO3 → CH3 – C – СН3 + H2O
׀ ׀
CH3 CH3
2 – каталітичне окислення:
 →CH3 – СН – CH2OH
→CH3 – СН – CH2OH
׀
CH3

 kat O
kat O

 СН3 – CH – СН3 + [O] → CH3 – CH – C
СН3 – CH – СН3 + [O] → CH3 – CH – C
 200°C׀H
200°C׀H
CH3 CH3
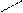
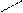 O
O
 → СH3 – CH – C
→ СH3 – CH – C
׀ OH
3 – дегідрогенізація:CH3
СН3 – CH – СН3 → СН2 = С – CH3 + Н2
׀ Ni׀
CH3 CH3
Добування алканів
1 – гідрогенізація ненасичених вуглеводнів:
СН2 = СН2 + Н2 → СН3 – СН3
СН ≡ СН + 2Н2 → СН3 – СН3
2 – нарощування вуглецевого ланцюга:
hυ
І етап – галогенування CH4 + Cl2 → CH3Cl + HCl
ІІ етап – реакція ВюрцаCH3Cl + 2Na + ClCH3 → СН3 – СН3 + 2NaCl
Використання алканів у медицині
Вазелін –суміш рідких та твердих вуглеводнів, в молекулах яких до 15 атомів С.
Основа для виготовлення мазей.
Парафін –суміш твердих вуглеводнів ( до 40 атомів С ). Використовують для
теплових процедур.
Озокерит –суміш твердих вуглеводнів ( більше 40 атомів С ). Використовують для теплових процедур.
· це насичені вуглеводні циклічної будови (циклопарафіни).
Загальна формула СnH2n.
Гомологічний ряд циклоалканів:




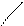 С3Н6 циклопропан СН2
С3Н6 циклопропан СН2
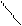 або
або

 Н2С СН2
Н2С СН2
 |
С4Н8 циклобутан

С5Н10 циклопентан

С6Н12 циклогексан


 Ізомерія:СН3
Ізомерія:СН3
–за вуглецевим скелетом
циклогексан метилциклопентан
 – міжкласова (з алкенами) СН2 = СН – СН2 – СН3
– міжкласова (з алкенами) СН2 = СН – СН2 – СН3
циклобутан бутен
Електронна будова:
· тип гібридизації sp3
· хімічні зв’язки – одинарні, σ – звязки
· 
 валентні кути: 60° 90°
валентні кути: 60° 90°
В малих циклах (циклопропан та циклобутан) кути сильно відрізняються від тетраедричного 109°28′, тому такі цикли напружені й нестійкі, легко розриваються. Для малих циклів характерні реакції приєднання (з розривом циклу).
Молекули інших циклів можуть приймати різні конформації, зберігаючи тетраедричний валентний кут. Для них, як і для алканів, характерні реакції заміщення.
Фізичні властивості: С3 – С4гази
С5 – С10рідини
С11 і більше –тверді
Без кольору та запаху, нерозчинні у воді.
Хімічні властивості малих циклів
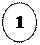
– приєднання:

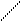 а) гідрогенізація СН2 Ni
а) гідрогенізація СН2 Ni
+ Н2 → СН3 – CH2 – СН3
 Н2С СН2
Н2С СН2
 |
б) галогенування+Cl2 → СН2 – CH2 – СН2
׀׀
Cl Cl
 в) гідрогалогенування +НCl → СН3 – CH2 – СН2
в) гідрогалогенування +НCl → СН3 – CH2 – СН2
׀
Cl
Хімічні властивості великих циклів
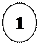

 hυ
hυ
 – заміщення: +Cl2 → Cl + НCl
– заміщення: +Cl2 → Cl + НCl


 Ni
Ni
 – дегідрогенізація: → +3Н2
– дегідрогенізація: → +3Н2
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Порядок здійснення перевірок суб'єктів, що використовують водні ресурси або виконують господарську діяльність у межах водоохоронних зон | | | Добування ацетилену |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |