
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Гідрогалогенування і дегідрогалогенування
Гідрогалогенування – приєднання гідрогенгалогенідів +HHal (HCl, HBr), а дегідрогалогенування – відщеплення гідрогенгалогенідів –HHal (HCl, HBr);
Гідрогенгалогеніди приєднуються до ненасичених сполук, що містять кратні (подвійні чи потрійні) зв’язки, а також до циклопропану з утворенням галогенопохідних, наприклад:

До потрійного зв’язку гідрогенгалогеніди приєднуються по стадіях:

Якщо вихідний субстрат (алкен, алкін чи карбоциклічний вуглеводень) має несиметричну будову, то напрямок приєднання до нього гідрогенгалогенідів та інших реагентів, що складаються з полярних молекул (HHal, H2O, HNH2), визначається відповідно до правила Марковникова:
При взаємодії несиметричних ненасичених сполук з полярними молекулами типа НХ атом гідрогену приєднується до найбільш гідрогенізованого атома карбону (тобто сполученого із більшою кількістю атомів Н), який утворює кратний зв¢язок.
Як приклад можна навести реакцію гідробромування пропену і етилциклопропану:


Необхідно зауважити, що не вся реакції приєднання гідрогенгалогенідів та інших полярних молекул типу НХ до кратних зв’язків підлягають правилу Марковникова. Якщо у b-положенні відносно кратного зв’язку міститься сильна електроноакцепторна група (наприклад, –СHal3, –СООН, –СНО, –NO2, –СºN), то приєднання HHal проходить проти правила Марковникова. Це пояснюється тим, що електроноакцепторна група за рахунок негативного індуктивного чи мезомерного ефекту відтягує у свій бік електронну густину подвійного зв’язку, що призводить до його поляризації та виникненню часткових зарядів δ+ і δ– на атомах карбону, як це показано на схемі:
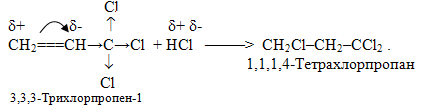
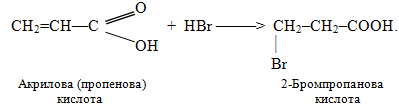
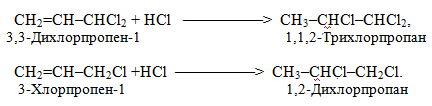
Однак у випадках моно- і дигалогензаміщених алкенів реакції проходять згідно з правилом Марковникова:
Ще одним виключенням з правила Марковникова є реакція приєднання HBr у присутності пероксидних сполук (Н2О2, С6Н5СОООН, Na2O2 тощо), яка відбувається проти правила Марковникова, оскільки при цьому діє так званий пероксидний ефект Харраша (див. лекцію 10), наприклад:

Реакції дегідрогалогенування (–HНal) – це відщеплення атомів Н і Hal від двох сусідніх атомів карбону, проводиться при дії на галогенопохідні спиртовим розчином лугу. У випадку несиметричних галогеновуглеводнів необхідно брати до уваги правило Зайцева:
У реакціях дегідрогалогенування атом гідрогену відщеплюється переважно від сусіднього найменш гідрогенізованого атома карбону.
Приклади реакцій дегідрогалогенування:



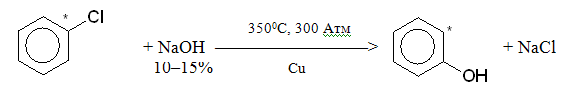
Арилгалогеніди навіть при тривалому кип¢ятінні з водним розчином лугу не гідролізується, однак за жорстких умов у присутності мідного каталізатора дають феноли:
| <== попередня сторінка | | | наступна сторінка ==> |
| Галогенування і дегалогенування | | | Гідратація та дегідратація |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |