
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Галогенування і дегалогенування
Галогенування і дегалогенування – відповідно введення галогенів при взаємодії сполуки з Hal2 і відщеплення їх (–Hal2). Продуктами реакцій галогенування є моно- чи полі галогенопохідні – залежно від кількості атомів галогену, що вводиться у молекули вихідної сполуки. Галогенування може проходити за різних умов за допомогою різних реагентів за відмінними механізмами реакцій (лекція 10). Розглянемо найважливіші реакції галогенування.
1) Галогенування алканів CnH2n+2 з утворенням галогеноалканів. Швидкість реакції та глибина заміщення залежать як від характеру атомів карбону (первинний, вторинний, третинний), так і від природи галогену: з F2 вони реагують навіть у темряві, іноді – з вибухом, тому ці реакції, як правило, не проводяться, з Cl2 реакція протікає при опромінюванні розсіяним світлом (hn); з Br2 – при ультрафіолетовому опромінюванні (УФ) чи при нагріванні (t=3000С); з І2 навіть у присутності каталізаторів реакція дає дуже малий вихід, тому йодопохідні одержують іншим шляхом. З урахуванням названих особливостей реакцій галогенування з практичне значення має взаємодія алканів з Cl2 i Br2, яка проходить за механізмом радикального заміщення SR і приводить до одержання суміші продуктів від моно- до полі галогенопохідних, наприклад:
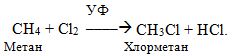
Галогеналкани мають дещо підвищену реакційну здатність порівняно з алканами у реакціях радикального заміщення SR. Наприклад, хлорування проходить значно легше, причому новий атом хлору вступає в a-положення відносно того галогену, який вже міститься у ланцюгу, а при неможливості такого напрямку реакції – у b-положення:
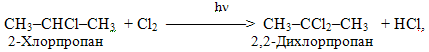
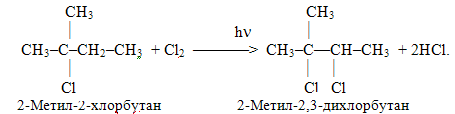
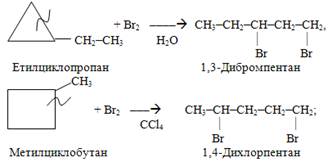
2) Галогенування циклоалканів при опромінюванні проходить при заміщенні атомів Н галогеном, наприклад:
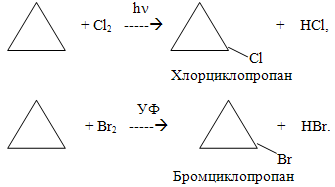
Однак дія на малі цикли бромною водою чи галогенами, розчиненими в органічних розчинниках, дає дигалогенопохідні і супроводжується руйнуванням циклу, причому атоми Hal приєднуються на місці розриву зв¢язку С1–С2 чи С1–С3 у циклі:
3) Галогенування алкенів та інших сполук, що містять подвійний зв’язок, при взаємодії з галогенами (переважно Cl2 чи Br2) дає віцінальні дигалогеналкани, тобто такі, що містять по одному атому галогена біля двох сусідніх атомів С:
CCl4
CH3–CH=CH2 + Br2 –––––––> CH3–CHBr–CH2Br.
Пропен 1,2–Дибромпропан
Реакцію проводять у неполярних розчинниках (CCl4), щоб уникнути утворення побічних продуктів.
При взаємодії з Br2 відбувається знебарвлення брому внаслідок його приєднання до алкенів, тому ця реакція є якісною на подвійний зв¢язок.
4) Галогенування алкадієнів.Якщо субстратом у реакції галогенування є дієновий вуглеводень, то залежно від його будови, природи галогену і умов проведення реакцій можуть утворюватися різні продукти. Найчастіше приєднання стехіометричної кількості (1:1) хлору Cl2 приводить до приблизно однакового виходу 1,2- і 1,4-дихлоралкенів, а при бромуванні переважає 1,4-продукт:
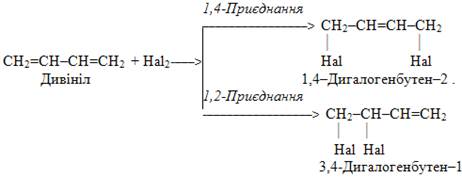
При надлишку галогену утворюються тетрагалогеналкани:
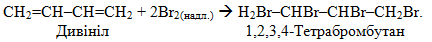
5) Галогенування алкінів проходить повільніше, ніж з алкенами. Так, подібно до олефінів ацетиленові вуглеводні знебарвлюють бромну воду (якісна реакція на кратний зв¢язок!):
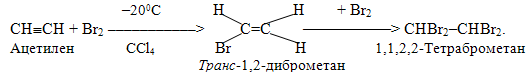
Зважаючи на те, що потрійний зв¢язок має меншу реакційну здатність порівняно із подвійним, при обмеженій кількості галогену за певних умов стає можливим селективне приєднання Hal2 саме до подвійного зв¢язку при одночасній наявності в молекулі і потрійного зв¢язку, наприклад:

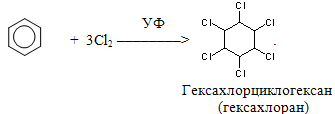
6) Галогенування ароматичних сполук є реакцією заміщення, що проходить у присутності каталізатора – так званих кислот Льюіса (тобто речовин, здатних зв¢язувати вільну електронну пару іншої частинки; до них належать: AlCl3, FeCl3, AlBr3, FeBr3, SnCl4, TiCl4, BF3). Практичного значення набули реакції хлорування та бромування, тому що реакція з хімічно активним F2 протікає деструктивно, а з І2 – дає надзвичайно малий вихід завдяки низькій реакційній здатності йоду.
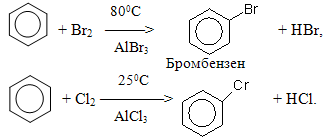
Галогенування похідних бензену за наявності каталізатора проходить з урахуванням орієнтуючої дії замісників І і ІІ роду.
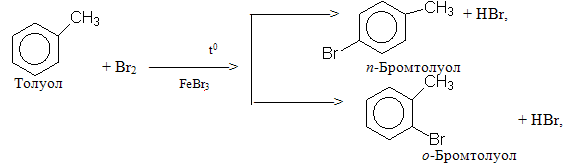
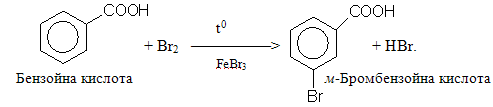
Якщо бензен піддають хлоруванню при інтенсивному ультрафіолетовому опромінюванні (без каталізатора), то реакції проходять за іншим механізмом:
У гомологів бензену при галогенуванні в умовах опромінювання відбувається заміщення атома Н при бензеновому атомі карбону (тобто такому, що знаходиться у боковому ланцюгу і займає положення, найближче до бензенового кільця), наприклад:
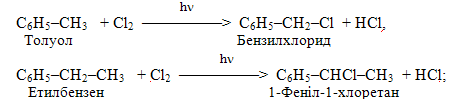
7) Галогенування насичених карбонових кислот і насичених карбонільних сполук є реакцією заміщення, яке переважно проходить по a-положенню відносно функціональної групи. Найчастіше проводять галогенування хлором чи бромом у присутності каталітичної кількості червоного фосфору або при опромінюванні:
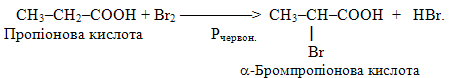
З терміном дегалогенування найчастіше пов’язують відщеплення атомів галогену від галогенопохідних.
У випадку віцінальних дигалогенопохідних (тобто таких, в яких атоми галогенів сполучені з двома сусідніми атомами С) при дії на них активними металами (Zn, Mg, Na) утворюється подвійний зв’язок:

Якщо дегалогенуванню піддають ізольовані дигалогеналкани, одержують циклічні продукти, наприклад:
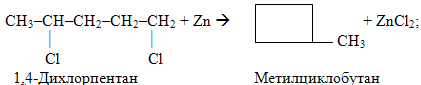
До реакцій де галогенування належить і реакція Вюрца, за допомогою якоїдобувають алкани при дії металічного натрію на галогенопохідні при незначному нагріванні:
СН3–Br + 2Na + Br–CH3 à CH3–CH3 + 2NaBr;
Якщо натрієм діяти на суміш різних галогенопохідних, то реакція одночасно протікає за трьома різними схемами і утворюється суміш трьох алканів:
СnН2n+1–Cl + 2Na + Cl–СnН2n+1 à СnН2n+1–СnН2n+1 + 2NaCl;
СmН2m+1–Cl + 2Na + Cl–СmН2m+1 à СnН2n+1–СmН2m+1 + 2NaCl;
СnН2n+1–Cl + 2Na + Cl–СmН2m+1 à СnН2n+1–СmН2m+1 + 2NaCl;
Дегалогенування гемінальних дигалогенопохідних, які містять два атоми галогену біля одного атома карбону, частіше називають іншим терміном – лужний гідроліз, внаслідок якого залежно від розташування атомів Hal у карбоновому ланцюгу одержують альдегіди чи кетони, наприклад:

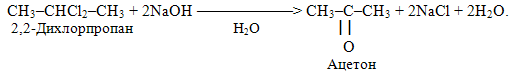
Дегалогенування гемінальних тригалогеновуглеводнів, що містять всі три атоми галогену в крайньому положеннні ланцюгу, проводять як реакцію гідролізу у кислому чи у лужному середовищі, наприклад:
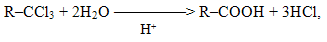
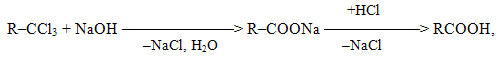
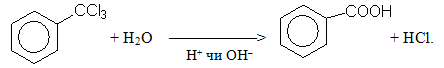
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| КЛАСИФІКАЦІЯ ЗА ПРИРОДОЮ ЧАСТИНОК | | | Гідрогалогенування і дегідрогалогенування |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |