
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Галогенування (галоїдування).
Введення атому галогену в молекулу органічної сполуки за допомогою:
– заміщення атому водню на атом галогену

- галогенування ароматичних сполук галоген-катіоном отримало назву реакції Біркенбаха-Губо-Уотерса

- галогенування карбонових кислот в α-положення при дії галогену і червоного фосфору називають реакцією Гелля-Фольгарда-Зелінського

– заміщення групи атомів або атому, відмінного від водню на галоген

Y = OH, NR2, OSO3R, R, SO3H і інші.
- для галогенування ароматичного ядра успішно використовується заміщення діазогрупи на галоген по реакції Гаттермана, Зандмейєра або Швехтена – розглянемо пізніше.
– приєднання атомів галогену по подвійному зв’язку

Галогенування, в основному хлорування і менше фторування широко поширені в промисловості. Реакція бромування має менше значення; це в першу чергу пов’язано зі значно вищою ціною брому і його дефіцитом. Але для синтезів фармацевтичних препаратів і препаративних реакцій бром найбільш широко використовується. Реакція йодування використовується рідко, але дуже цінна для аналізу органічних сполук.
Галогенуючими засобами служать, в першу чергу, самі галогени. Реакції галогенування сильно розрізняються по енергетичним характеристикам, що визначає їх суттєві особливості.
Приведемо значення теплових ефектів реакцій галогенування:
| Використовуваний галоген | Тепловий ефект для реакції, ккал/моль | |
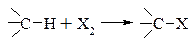
| 
| |
| F | ||
| Cl | ||
| Br | ||
| I | -12 |
Як видно з приведених даних, теплові ефекти зменшуються від фтору до йоду, причому особливе місце займають фторування і йодування. Дія фтору на органічні сполуки супроводжується таким значним виділенням тепла, який перевищує енергію розриву зв’язків С–С і С–Н, і, якщо не прийняти запобігливих засобів, пряме фторування може привести до глибокого розкладу ОС. Реакції заміщення атомів водню на фтор, хлор і бром екзотермічні і незворотні. Теж відноситься і до реакцій приєднання по подвійному вуглець-вуглецевому зв’язку при помірних температурах (до 400°С). Відносно йоду, то безпосередня взаємодія його з вуглеводнями є процесом рівноважним. По цій причині, а також внаслідок малої активності йоду порівняно з іншими галогенами пряме йодування вуглеводнів зустрічає певні труднощі, в зв’язку з чим йодопохідні отримують обхідними шляхами.
5.1. Хлорування аліфатичних сполук.
Практичне застосування методів галогенування в аліфатичному ряді виражається в багатотоннажних продуктах, які широко використовуються:
– галогенорганічні мономери і вихідні речовини для отримання високомолекулярних сполук (хлористий вініл, хлоропрен, тетрафторетилен і т.д.
– галогенорганічні ядохімікати;
– хлорорганічні розчинники
– проміжні продукти органічного синтезу (хлористий метил, хлористий етил, хлористий бензил, хлорбензен і т.д.).
Використання методів хлорування ароматичних сполук обмежено тим, що більшість ароматичних сполук дає суміші продуктів хлорування, які досить важко розділити.
При галогенуванні алкілароматичних сполук необхідно, крім того, рахуватися з можливістю конкурентної реакції радикального заміщення в боковий ланцюг.
Умови необхідні для переважного протікання галогенування в ядро або бічний ланцюг, вказує правило:
– Нагрівання до температури кипіння, сонячне світло – бічний ланцюг (Siedehitze, Sonnenlbcht – Seitenkette "SSS")
– Холод, каталізатор – ядро (Kalte, Katalisator – Kern "KKK").
Хлорування аліфатичних сполук добре розглянуте в курсі органічної хімії, тому обмежимося тільки анотацією. При термічному галогенуванні, яке звичайно протікає в газовій фазі, розщеплення молекули хлору досягається при високих температурах. Температура, яка необхідна для зародження радикального ланцюга, складає 250-300°С, але на практиці процес з метою пришвидшення ведуть при 250-500°С. Інший шлях зародження радикалів – опромінення реакційної маси (фотохімічне і радіаційно-хімічне галогенування) або використання ініціаторів, які здатні при помірних температурах розпадатися з утворенням вільних радикалів.
При реакціях хлорування відщеплення хлористого водню є небажаним процесом. При цільовому отриманні монохлоралканів з коротким вуглецевим ланцюгом дегідрохлорування стає відчутним при 400-500°С, для хлорпентану – при 300°С, а для хлорпарафінів вже при 150°С. Цим обмежується температура при термічному хлоруванні.
5.2. Хлорування ароматичних сполук
В наш час реакція хлорування, поряд з реакціями сульфування і нітрування, є одним з основних методів введення галогену в ароматичну сполуку, які використовують на виробництві. Хлоруванню піддають бензен, толуен, ксилол, нітро-, аміно-, гідроксисполуки. Крім вільного хлору для реакції використовують гіпохлорит, хлороводневу кислоту в присутності окислювачів, сульфурилхлорид, хлорангідриди неорганічних кислот.
Елементний хлор на холоді в темряві в відсутності каталізатора не реагує з бензеном, його гомологами і іншими ароматичними сполуками. Під дією світла в відсутності каталізатора бензен взаємодіє з хлором; при цьому проходить приєднання хлору, а не заміщення атому водню. В присутності каталізатора йде заміщення атому водню в ароматичному ядрі з виділенням хлористого водню. При дії хлору на гомологи бензену, наприклад толуен, можливе заміщення атому водню як в ароматичному ядрі, так і в бічному ланцюзі.
Каталізатором при заміщенні в ароматичному ядрі можуть служити хлористе залізо (ІІІ), йод, хлористий алюміній, окис алюмінію, сульфатна кислота і т.п. Найбільш широке практичне застосування знайшов хлорид заліза (ІІІ). Звичайно в реакцію вводять металічне залізо у вигляді стружки або обрізків чорної жесті; в ході реакції при взаємодії з хлором воно переходить в хлорне залізо.
5.2.1. Хлорування бензену
При хлоруванні бензену утворюється хлорбензен, який здатний хлоруватися з утворенням дихлорбензену. Утворення дихлорбензену проходить в 8-10 разів повільніше, ніж утворення хлорбензену. Таким чином, протікає типова послідовно-паралельна реакція. Було визначено, що при 25°С максимальна концентрація хлорбензену складає 74,6%, при цьому в реакційній масі залишається 5,8% вихідного бензену і утворюється 19,6% дихлорбензену.
Тому при хлоруванні бензену доводиться зупиняти реакцію, коли значна кількість хлорбензену залишається непрореагованим. Реакцію ведуть при температурі 75-95°С в присутності каталізатора хлористого заліза (ІІІ). Бензен, який не вступив в реакцію відділяють від хлорбензену і повертають в зону реакції.
Для отримання хлорбензену в промисловості використовують також метод окислювального хлорування, яке проводять в паровій фазі над каталізатором з використанням в якості хлоруючого агенту хлористого водню і кисню повітря.
5.2.2. Хлорування заміщених бензену
Фенол хлорується легко. Монохлорфенол і його гомологи отримують при дії м’якого хлоруючого агента сульфурилхлориду. При повільний придачі до фенолу при 40°С сульфурилхлориду з наступним нагріванням при 85°С отримують суміш о- і п-ізомерів (більше п-ізомера), яку розділюють перегонкою в вакуумі.
При хлоруванні фенолу хлором при 45-50°С утворюється 2,4-дихлорфенол, який при більш тривалій обробці хлором при 50-65°С легко утворює 2,4,6-трихлорфенол, який при подальшому хлоруванні в розчині моногідрату і хлорсульфонової кислоти перетворюється в 2,3,5,6-тетрахлор-1,4-бензохінон (хлораніл).
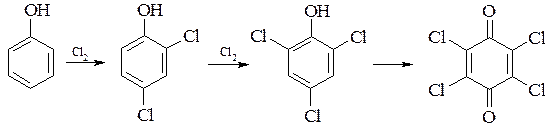
Анілін взаємодіє з хлором також легко. Дія хлору на анілін в неводному розчиннику приводить до 2,4,6-трихлораніліну. При проведенні реакції в водному середовищі крім 2,4,6-трихлораніліну утворюються забарвлені продукти окислення.
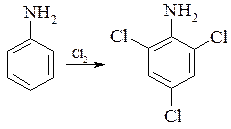
Нітрозаміщені ароматичні аміни гладко хлоруються в кислому середовищі без попереднього ацилювання. Так, при добавленні до суспензії п-нітроаніліну в соляній кислоті розчину хлорату натрію утворюється 4-нітро-2,6-дихлоранілін.

Цю сполуку можна отримати при дії хлору на 2-аміно-5-нітробензен-1-сульфокислоту; при цьому сульфогрупа заміщується атомом хлору.
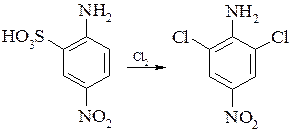
5.2.3. Ізомеризація хлорзаміщених.
При хлоруванні бензену утворюється суміш о- і п-дихлорбензенів і незначна кількість мета-ізомеру. При хлоруванні бензену до трихлорзаміщеного в суміші практично відсутній симетричний 1,3,5-трихлорбензен. При хлоруванні нафталену кількість 2-хлорнафталену не перевищує 10%. Однак ізомери, які не утворюються при хлоруванні або утворюються в незначній кількості, часто представляють інтерес.
В зв’язку з цим був досліджений процес ізомеризації легкодоступних хлорзаміщених з метою отримання важкодоступних ізомерів. Так, о- і п-дихлорбензени в присутності хлористого алюмінію і хлороводню при підвищеній температурі перетворюються в м-дихлорбензен. При 160°С утворюється рівноважна суміш, яка містить 54% мета-ізомера, 30% пара- і 16% орто-ізомера.

1-Хлорнафтален при 20-50°С в присутності хлористого алюмінію ізомеризується в 2-хлорнафтален. Більш гладко ізомеризація протікає над алюмосилікатним каталізатором або в потоці хлороводню над оксидом алюмінію. Вміст 2-хлорнафталену в суміші складає 55-60%.
5.3. Бромування
В лабораторній практиці простіше всього проводити бромування. А в виробничій практиці бромування проводять в значно менших масштабах. Через високу вартість брому, який приблизно в 15 разів дорожчий за хлор, процес намагаються провести так, щоб розхід брому був мінімальний. З цією метою в реакційну масу вводять окислювач (хлор, гіпохлорит натрію) для перетворення бромоводню в бром.
В промисловості бромування використовують для отримання цінних галоген похідних.
В лабораторній практиці фенол і анілін бромуються дуже легко, навіть з бромною водою вони зразу утворюють триброміди. Знизити реакційну здатність аміногрупи і ввести меншу кількість атомів брому вдається ацилюванням з наступним зняттям ацильного захисту.
Цікаві результати отримують при бромуванні гваяколу (о-метоксифенолу): бромування йде переважно в пара-положення до гідроксигрупи, так як +М ефект цієї групи більший чим метоксигрупи.

Картина змінюється, якщо бромувати ацильований гваякол. В даному випадку +М ефект метоксильної групи більше, чим в групі СН3СОО, в якій атом кисню зв’язаний з електроноакцепторною групою.
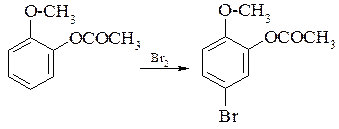
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Реакції нітрозування. | | | Реакції відновлення |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |