
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції відновлення
Реакцією відновлення називають реакцію приєднання водню по кратним зв’язкам молекули органічної сполуки або видалення кисню, яке супроводжується заміщенням його на водень.
Процеси відновлення органічних сполук протікають в результаті заміщення, приєднання або відщеплення:
– заміщення кисню або інших атомів на атом водню

- відновлення α-амінокислот або їх ефірів в аміноальдегіди амальгамою натрію (Na/Hg, HCl, 20°C) – реакція Акаборі
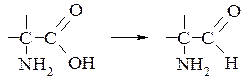

- відновлення ароматичних нітросполук в аміни сульфідом амонію носить назву реакції Зініна, а під дією залізної стружки в розведених кислотах – реакція Бешана

– приєднання атомів водню по подвійному зв’язку



де Z = N, O, S
– відщеплення одного або кількох атомів кисню з утворенням циклу або подвійного зв'язку
– відновлення азобарвника з отриманням беназолу (хімічне, електрохімічне або каталітичне).
Приведемо теплові ефекти деяких реакцій відновлення гідруванням в газоподібному стані (ккал/моль):
RCH=CH2 → RCH2CH3 27-32
HC≡CH → CH3CH3 74,4
C6H6 → C6H12 49,3
RCHO → RCH2OH 16-20
RNO2 → RNH2 105-113
Гідрування аліфатичних сполук не має значного інтересу як для практичної хімії, так і для препаративної.
6.1. Гідрування кисневмісних сполук
Спирти, альдегіди, кетони, карбонові кислоти можуть містити ненасичені вуглець-вуглецеві зв’язки або ароматичні системи, які здатні відновлюватись. В одних випадках необхідно гідратувати тільки їх, а в інших, навпаки, необхідно селективно відновити кисневмісні групи. Розглянемо умови в яких відбуваються ті або інші реакції.
6.1.1. Гідрування аліфатичних спиртів.

Гідрування спиртової групи найбільш ефективно протікає з нікелем Ренея. Реакція проходить при 200-300°С. Гідрування спиртів по гідроксигрупі не має практичного значення.
Навпаки, селективне гідрування ненасичених вуглець-вуглецевих зв’язків в ненасичених спиртах має практичний інтерес для синтезу деяких спиртів. Подвійний зв’язок в олефінових спиртах і потрійний в ацетиленових гідрується зі збереженням спиртової групи на різноманітних каталізаторах (Ni, Co, Cu, Pd, Pt). Так, бутендіол-1,4 і бутандіол-1,4 синтезують з ацетилену і формальдегіду через бутиндіол-1,4:
HC≡CH + 2HCHO → HOCH2–C≡C–CH2OH →
HOCH2–CH=CH–CH2OH → HOCH2–CH2–CH2–CH2OH
Перша стадія гідрування протікає на залізному каталізаторі, а перетворення в бутандіол – на нікель-мідь-хромітному контакті при 180-200°С і 200ат.
6.1.2. Гідрування аліфатичних альдегідів і кетонів
Насичені альдегіди і кетони гідруються по карбонільній групі з утворенням відповідно первинних і вторинних спиртів. В якості каталізаторів використовують нікель на носіях, мідь.
Альдегідна група гідрується значно легше ніж кетонна. Відновлення альдегідів часто можна провести в м’яких умовах при 50-150°С, відновлення кетонів вимагає 150-250°С і відповідно при тиску 10-20атм на нікелевому каталізаторі, 50-150атм з хромітами і до 300атм з сульфідами металів.
6.1.3. Гідрування ароматичних кисневмісних сполук
Гідрування фенолів може протікати по двох напрямках: насиченням ароматичної системи з утворенням циклогексану, або з відновленням гідроксильної групи.
Фенол при гідруванні на нікелевому каталізаторі при 130-150°С і 5-20атм дає циклогексанол, який використовують для синтезу циклогексанону, адипінової кислоти і капролактаму.
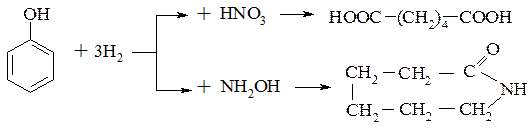
Гідрування гідроксигрупи зі збереженням ароматичності протікає значно важче. Ця реакція використовується при необхідності очистки від малоцінних фенолів продуктів переробки твердого палива. Як каталізатор використовують сульфід кобальту при 200°С і 100-200 атм.
6.2. Відновлення ароматичних нітросполук.
Відновлення ароматичних нітросполук – це один з основних методів отримання ароматичних амінів. Ароматичні аміносполуки використовують в синтезі всіх класів органічних барвників, в синтезі фармацевтичних препаратів, допоміжних продуктів для гумової промисловості, для сільського господарства і т.д.
При відновленні ароматичних нітросполук може бути отриманий ряд продуктів: нітрозо- (1), гідроксиламіносполуки (2), азокси-(3), азо-(4), гідразосполуки (5) і аміни (6). Напрямок реакції відновлення залежить як від природи відновника, так і від умов відновлення:
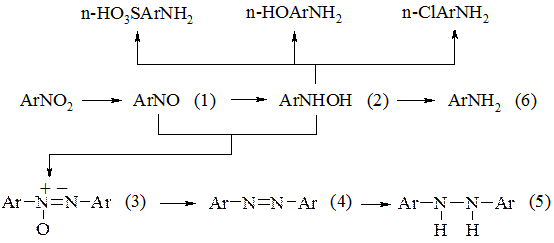
Вплив умов відновлення на його результати пояснюється багатостадійністю цього процесу. В ході відновлення утворюються арилгідроксиламіни, які є надзвичайно реакційноздатними продуктами, що здатні взаємодіяти не тільки з відновником, але і з присутніми в реакційній масі нітрозосполуками. Крім того, в залежності від рН середовища і природи відновника арилгідроксиламіни здатні здійснювати різні перетворення. При відновленні металами в сірчаній кислоті арилгідроксиламін здатний перетворюватися в аміногідроксисполуки, тобто одночасно з відновленням нітрогрупи в молекулу вводиться гідроксигрупа. При відновленні металами в соляній кислоті часто утворюються хлорзаміщені аміни, тобто крім утворення аміногрупи в ядро вступає хлор.
Відновлення нітросполук до амінів проходить гладко в тому випадку, коли швидкість перетворення арилгідроксиламіна в амін значно вища, ніж швидкість інших реакцій арилгідроксиламіна. Це спостерігається при відновленні нітросполуки залізом в присутності розчинів електролітів, а також при відновленні нітросполук сульфітами металів в лужному середовищі залізом або міддю в сильнокислому середовищі. Однак при відновленні нітросполук металами (цинком) в лужному середовищі швидкість перетворення арилгідроксиламіна в амін значно менша, ніж швидкість взаємодії арилгідроксиламіна з нітрозосполукою з утворенням азоксисполуки. Азоксисполука, яка утворюється в такому випадку, надалі відновлюється до азо- і гідразосполук. Відновлення нітросполук до гідразосполук має значення, так як таким чином шляхом бензидинового перегрупування перетворюються в діаміни ряду біфеніла – бензидинові основи.
Таким чином, змінюючи умови відновлення, вибираючи необхідний відновник, можна змінювати напрямок процесу відновлення в сторону утворення того або іншого цільового продукту.
6.2.1. Відновлення залізом в середовищі електроліту.
Метод відновлення нітросполук до амінів при дії заліза в середовищі електроліту є одним з основних технічних способів отримання ароматичних амінів. Для цього методу характерні: високий вихід цільового продукту, відсутність побічних продуктів, дешевизна відновника і простота технологічного обладнання. Як електроліт використовують солі заліза (хлорид, ацетат, форміат), солі амонію (сульфат, хлорид), інколи хлорид натрію і сульфат заліза (2). Звичайно до водного розчину електроліту при нагріванні і розмішуванні добавляють залізо у вигляді стружки і нітросполуку, і нагрівають реакційну масу при температурі кипіння.
Іноді електроліт готують безпосередньо в апараті для відновлення, при обробці заліза соляною, оцтовою або мурашиною кислотою. Кількість електроліту звичайно складає 0,1-0,2 молі на моль нітросполуки. Найвища швидкість відновлення спостерігається при використанні хлоридів амонію і заліза, дещо менша швидкість – при використанні сульфату амонію.
В реакційній масі вільна кислота відсутня і відновлення протікає в нейтральному або навіть в слаболужному середовищі, в основному на поверхні заліза.
Розрахункове рівняння реакції відновлення ароматичних нітросполук залізом в присутності електроліту є рівняння:
4ArNO2 + 9Fe + 4H2O → 4ArNH2 + 3Fe3O4
Відновлення нітросполук чавунною стружкою в середовищі електроліту отримують о- і п-толуїдини, о-хлоранілін, 2,5-дихлоранілін, N-ацет-п-фенілендіамін, п-фенілендіамін, м-фенілендіамін.
Недоліком методу відновлення залізною стружкою є необхідність утилізації залізного шламу, який забруднений амінами. Тому тепер цей метод поступається методу каталітичного відновлення воднем.
6.2.2. Відновлення металами в кислому середовищі
Відновлення металами (цинком і т.п.) в кислому середовищі (соляна, оцтова і т.п.) часто використовують в лабораторній практиці. Відновлення солями ванадію (ІІІ), титану, олова використовується для кількісного визначення нітрогрупи.
При відновленні металами в солянокислому середовищі може проходити одночасне хлорування ароматичного аміну. Так при відновленні нітробензену магнієм в соляній кислоті з виходом до 66% утворюється хлоранілін.

При відновленні в середовищі сульфатної кислоти поряд з аміногрупою в ароматичне кільце може вступати гідроксигрупа. Так при відновленні нітробензену цинком в концентрованій сірчаній кислоті при 60-80°С утворюється п-амінофенол, а при відновленні м-нітробензойної кислоти – 5-аміно-2-гідроксибензойна кислота.
6.2.3. Відновлення солями сірчистої кислоти.
При відновленні ароматичних нітросполук солями сірчистої кислоти поряд з утворенням аміногрупи в ароматичне ядро вступає сульфогрупа. Тому в реакційній суміші крім аміну присутні аміносульфокислоти, а іноді навіть амінодисульфокислоти. В якості відновника використовують кислі і середні солі сірчистої кислоти (бісульфіти і сульфіти). Наявність в ароматичному ядрі нітросполуки електронодонорних замісників сприяє утворенню амінів, а електроноакцепторних замісників або системи конденсованих ароматичних кілець сприяє утворенню аміносульфокислот.
Так при нагріванні м-динітробензену з розчином сульфіту натрію з наступним кип’ятінням утвореного розчину в якості основного продукту реакції отримують 5-аміно-2-нітробензен-1-сульфокислоту.

Бісульфіт натрію використовують у виробництві 4-аміно-3-гідроксинафтален-1-сульфокислоти (ЕХТ к-ти). При дії на 2-гідрокси-1-нітрозонафтален бісульфіту натрію (не менше 2 молі) при 5°С з наступним підкисленням реакційної маси сірчаною кислотою і нагріванням до 50-60°С отримують ЕХТ к-ту.

6.2.4. Відновлення металами в лужному середовищі.
Відновлення металами в лужному розчині приводить до азокси-, азо- і гідразосполук.
На практиці використовується відновлення нітросполук цинковим пилом в середовищі гідроксиду натрію. Кількість цинку, який беруть на реакцію, на 10-15% перевищує теоретичну. Хоч по рівнянню реакції луг не витрачається, на практиці його витрата складає 0,1-0,2 молі на моль нітросполуки.

Кінцевим продуктом відновлення є гідразосполука, яка зазнає бензидинового перегрупування з утворенням діаміну ряду біфенілу. Перегрупування здійснюють під дією соляної або сульфатної кислоти при пониженій температурі (0-5°С). Основним продуктом перегрупування є 4,4-диамінопохідне.
6.2.5. Відновлення розчинами сульфідів в лужному середовищі
Відновлення ароматичних нітросполук розчинами сульфідів історично найстаріший метод відновлення. В 1842р Зінін вперше отримав анілін з нітробензену при використанні сульфіду амонію.
Цей метод використовується для часткового відновлення полінітросполук або нітроазосполук:


Як відновник використовують гідросульфід натрію, сульфід натрію, дисульфід і полісульфіди. Відновлююча дія ґрунтується на здатності сульфідів натрію окислюватись з утворенням тіосульфатів Na2S2O3. Відновлення протікає в достатньо сильному лужному середовищі. При використанні гідросульфіду натрію отримують м-нітроанілін, 2-аміно-4-нітрофенол.
6.2.6. Каталітичне відновлення воднем
Каталітичне відновлення воднем для отримання ароматичних амінів останнім часом набуває все більшого значення і витісняє в ряді випадків як відновлення чавунною стружкою в середовищі електролітів, так і відновлення сульфідами металів.
Парофазне відновлення використовують для отримання аніліну – багатотоннажного продукту. Реакція протікає при 300-370°С на каталізаторі (нікель, платина, паладій).
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- А – до відновлення, б – після відновлення.
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- Видалення та відновлення папок та файлів
- Види опор та їх реакції
- Види способів відновлення деталей
- Визначення реакції продуктів, кислотності і лужності.
- Відновлення вхідних даних або повідомлення
| <== попередня сторінка | | | наступна сторінка ==> |
| Галогенування (галоїдування). | | | Заміщення сульфогрупи гідроксильною групою і іншими замісниками |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |