
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ПЕРШЕ НАЧАЛО ТЕРМОДИНАМІКИ. ЕНТАЛЬПІЯ
Перший закон термодинаміки є наслідком закону збереження енергії, який в загальному вигляді був сформульований в середині ХVІІ ст. М.В.Ломоносовим. За цим законом в усіх явищах природи енергія не може зникнути безслідно або виникнути з нічого. Енергія може тільки перетворюватися з однієї форми в іншу в строго еквівалентних співвідношеннях. Цей закон є універсальним і підтверджується всім досвідом людства, це є найбільше відкриття ХІХ сторіччя.
Д.Бернал так охарактеризував його значення: «Він об’єднав багато наук і знаходився у винятковій гармонії з тенденціями часу....Вся людська діяльність у цілому – промисловість, транспорт, освітлення і, у кінцевому рахунку, харчування і саме життя – розглядалося з погляду залежності від цього одного загального терміна – енергія».
Перший закон термодинаміки розглядається як постулат, оскільки він не може бути виведений або доказаний яким-небудь логічним шляхом. Зміст І закону термодинаміки витікає із узагальнення багаторічного досвіду, що був накопичений людством унаслідок практичної діяльності. У наш час його справедливість визнана всіма вченими в галузі природничих наук, оскільки ні один із наслідків, до яких воно призводить, не знаходиться в суперечці з дослідом.
В загальній формі цей закон формулюється так: «В термодинамічних процесах різні форми енергії можуть переходити одна в одну в строго еквівалентних співвідношеннях, але при цьому енергія не витрачається і не створюється знову. Загальна енергія ізольованої системи залишається сталою, незалежно від змін, які відбуваються в цій системі»
Цей закон був вперше сформульований М.В.Ломоносовим у 1748 році як закон збереження руху. Після його смерті закон був забутий і повернутий в науку лише в 40-х роках ХІХ ст. працями Ю.Мейєра, Дж.Джоуля, Р.Клаузіуса і Гельмгольца, які дістали експериментальне підтвердження і конкретизацію даного закону.
Кожна система характеризується внутрішньою енергією U,яка
включає всі види енергії - енергію поступального та коливального рухів молекул, атомів, електронів; енергію їх взаємодії тощо, за винятком потенціальної енергії, що обумовлена положенням системи в просторі, і кінетичної енергії системи як цілого.
Обчислити абсолютне значення внутрішньої енергії системи неможливо. Обчислюють лише зміну внутрішньої енергії при переході системи з одного стану в інший.
Внутрішня енергія – це енергія, яка у прихованій формі знаходиться в кожному тілі.З підвищенням температури внутрішня енергія системи зростає.
Отже, неможливо створити пристрій (вічний двигун), який виконував би роботу без підведення енергії. Адже при цьому запас внутрішньої енергії системи мусив би зменшуватися. Якщо ж система обмінюється теплом з навколишнім середовищем, то зміна її внутрішньої енергії в процесі рівна різниці притоку теплоти (ΔQ) і виконаної системою роботи (А):
ΔU = ΔQ – A (1.1)
Або ΔQ = ΔU + А, (1.2)
Тобто, теплота, підведена до системи, тратиться на зміну її внутрішньої енергії (нагрів) і на виконання системою якоїсь роботи.
Дані рівняння є математичним виразом першого закону термодинаміки.
У будь-якому процесі збільшення внутрішньої енергії певної системи ΔU дорівнює наданій цій системі теплоті Q мінус кількість роботи А, яку виконала система.
Як приклад простої термодинамічної системи розглянемо газ, що знаходиться в циліндрі з поршнем (рис.1).
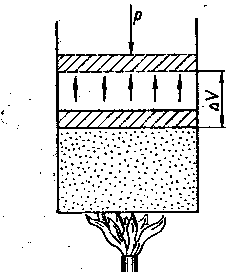 При підведенні до нього теплоти Q газ нагрівається (збільшується його внутрішня енергія U) і розширюється (виконується робота А). Таким чином, теплота Q витрачається частково на збільшення внутрішньої енергії ΔU і частково на здійснення роботи А проти зовнішніх сил:
При підведенні до нього теплоти Q газ нагрівається (збільшується його внутрішня енергія U) і розширюється (виконується робота А). Таким чином, теплота Q витрачається частково на збільшення внутрішньої енергії ΔU і частково на здійснення роботи А проти зовнішніх сил:
Q = ΔU + А
Для процесів, в яких здійснюється тільки робота розширення газу при постійному тиску: А = р ( V2 - V1)
Рис.1. Схема розширення газу в циліндрі
Рівняння першого начала термодинаміки матиме наступний вигляд:
Qp = Δ U + p (V2 - V1) Qp = U2 - U1 + pV2 - pV1 (1.3)
Звідки:
Qp = ( U2 + рV2) - (U1 + рV1)
Це означає, що теплота процесу при постійному тиску дорівнює різниці функції, що має вигляд:
U + pV = H (1.4)
Qp = H2 - H1 = Δ H (1.5)
Функцію Н називають ентальпією.
Ентальпія Н – це енергія, якою володіє система при сталому тиску.
Тепловий ефект реакції ΔН – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах.
ΔН = ΔН1 – ΔН2
Так як тиск Р і об’єм V – параметри стану, а U – функція параметрів стану, то й ентальпія Н також є функцією стану, тобто її зміна не залежить від напряму процесу, а визначається лише початковим і кінцевим станом системи.
З рівняння (1.5) видно, що теплота, яка поглинається системою при постійному тиску Р, дорівнює приросту ентальпії ΔН.
Якщо процес протікає без зміни об’єму V, тобто V2 - V1 = 0, то з рівняння (1.3) одержимо:
Qv = U2 - U1 = Δ U (1.6)
Різниця між величинами ΔU і ΔН досить велика для систем, що містять речовини в газоподібному стані. Якщо нагрівати газ при постійному об’ємі V, то вся теплота буде йти на збільшення внутрішньої енергії ΔU.
При нагріванні газу такою самою кількістю теплоти при постійному тиску Р він буде розширятися, витрачаючи частину теплоти Q на роботу розширення А. Тому зміна ентальпії буде включати в себе і зміну внутрішньої енергії ΔU, і ту кількість теплоти, яка пішла на розширення рΔV.
Для систем, речовини яких знаходяться в рідкому або кристалічному стані, в звичайних умовах різницею в величинах ΔU і ΔН можна знехтувати, бо об’єм рідин і твердих тіл при нагріванні змінюється незначно.
Читайте також:
- В начало
- В начало
- В начало
- В начало
- В начало
- В начало
- В начало
- В начало
- В начало
- В начало
- ВВЕДЕНО ВПЕРШЕМІСТ
- Внутрішня енергія та ентальпія
| <== попередня сторінка | | | наступна сторінка ==> |
| ОСНОВИ ХІМІЧНОЇ ТЕРМОДИНАМІКИ | | | ЗАКОН ГЕССА |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |