
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Внутрішня енергія та ентальпія
Ентропія, енергія Гіббса та напрямленість процесів
Закон Гесса і термохімічні розрахунки
Внутрішня енергія та ентальпія
ЕНЕРГЕТИКА ХІМІЧНИХ ПРОЦЕСІВ
ПРОЦЕСІВ
План
 Література
Література
/1/ - Романова Н.В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Розділ 5. § 5.1-5.2).
/2/ - Глинка Н. Л. Общая химия. – Л.: Химия, 1987. – 704 с.
(Глава VІ. § 66-68).
Хімічна термодинаміка — це наука, що вивчає перехід енергії з однієї форми в іншу; енергетичні ефекти, що супроводжують хімічні та фізичні процеси; можливість і напрямок перебігу того чи іншого процесу. Поряд із вченням про будову речовини термодинаміка становить теоретичну основу сучасної неорганічної хімії.
У хімічній термодинаміці користуються так званими термодинамічними функціями (характеристиками), які дають змогу охарактеризувати стан системи і зміни, що відбуваються в ній. Серед останніх важливе значення для хіміків мають внутрішня енергія U, ентальпія Н, ентропія S, енергія Гіббса G тощо.
Хімічні процеси відбуваються з виділенням або поглинанням теплоти. Реакції, що відбуваються з виділенням теплоти, називають екзотермічними, а реакції, під час перебігу яких теплота поглинається, — ендотермічними. Так, реакції горіння, нейтралізації кислот лугами супроводжуються виділен ням значної кількості теплоти. Виділення теплоти під час взаємодії речовин свідчить про те, що вони мають певний запас енергії у прихованому вигляді. Енергія, яка прихована в речовинах і вивільняється під час хімічних і деяких фізичних процесів, називається внутрішньою енергією речовини.
Для будь-якого процесу справедливий закон збереження енергії:
Q = ∆U + A
Це означає, що підведена до системи теплота Q в загальному випадку витрачається на зміну її внутрішньої енергії ∆U і на виконання роботи А. Під час термохімічних розрахунків прийнято вважати теплоту, що виділяється системою, додатною (у термодинаміці додатною вважається теплота, поглинута системою).
Під внутрішньою енергією системи U слід розуміти загальний її запас, тобто енергію поступального й обертального руху молекул, енергію внутрішньомолекулярних коливань атомів і атомних груп, енергію руху електронів в атомах, внутрішньоядерну енергію, тобто усі види енергії, крім кінетичної і потенціальної енергії системи в цілому. Під величиною А розуміють роботу, що протидіє всім силам, які діють на систему (зовнішній тиск, електричне і магнітне поля тощо).
Суму внутрішньої енергії і добутку об'єму речовини на зовнішній тиск називають ентальпією і позначають літерою H:
Н = U + РV.
Наукове і практичне значення має зміна ентальпії ∆H в ході процесу:
∆H = H2 – H1.
Якщо в ході процесу виконується тільки робота розширення і система перебуває за сталого тиску, то
А = Р∆V.
Звідси можна записати
∆H = ∆U + Р∆V, ∆U = ∆H – Р∆V.
Порівнюючи наведене вище рівняння з рівнянням внутрішньої енергії, бачимо, що за зазначених умов ∆H = Qp (Qp — теплота, яку поглинула система за сталого тиску).
Отже, як внутрішня енергія, так і ентальпія є важливими термодинамічними функціями. Математичний зв'язок між ними (∆H = ∆U + Р∆V) відображує зміст основного принципу термодинаміки: кількість теплоти ∆H, наданої будь-якій системі, використовується на приріст її внутрішньої енергії ∆U та на виконання механічної роботи.
Під час хімічних перетворень вивільнюється тільки частина енергії, яку мають речовини. Кількість виділеної або поглинутої теплоти називається тепловим ефектом реакції. Теплові ефекти хімічних процесів вивчає термохімія.
Внутрішня енергія, що виділяється лише під час перебігу хімічних реакцій, називається хімічною, під час вивільнення вона перетворюється на інші форми. Так, хімічна енергія сірки та кисню під час утворення оксиду сульфуру(ІV) виділяється у вигляді теплоти і світла, тобто хімічна енергія перетворюється на теплову і світлову. Перетворення хімічної енергії на електричну має місце у гальванічних елементах. Під час вибуху хімічна енергія перетворюється на механічну, теплову, світлову. Отже, хімічна енергія може перетворюватись на теплову, світлову, електричну, механічну і, навпаки, всі види енергії можна перетворити на хімічну: розкладання сполук під час нагрівання, під дією електричного струму (електроліз), освітлення (фотоліз АgВr). Величезне значення має перетворення світлової енергії на хімічну для життєдіяльності рослин (фотосинтез).
Енергетичні зміни, що супроводжують перебіг хімічних реакцій, мають иелике практичне значення. Термохімія оцінює стійкість сполук за тепловими ефектами їх утворення, а також ступінь енергетичної доцільності хімічних реакцій за певних умов.
Щоб забезпечити можливість порівняння теплових ефектів різних реакцій, термохімічні розрахунки слід робити відносно одного моля сполуки за температури 25 °С (298,15 К) і тиску 101 кПа (1 атм). Теплові ефекти, визначені за таких умов, називають стандартними.
Теплові ефекти можна зазначати поряд з рівняннями хімічних реакцій. Рівняння, біля яких зазначено тепловий ефект, називають термохімічними. Величину теплового ефекту записують справа від рівняння із знаком «мінус», якщо реакція екзотермічна, і зі знаком «плюс» — якщо ендотермічна.
Кількість теплоти, що виділяється або поглинається під час утворення одного моля хімічної сполуки з простих речовин, називається теплотою (ентальпією) утворення даної сполуки. Так, теплота утворення води дорівнює – 285,8 кДж/моль; це означає, що в процесі утворення 18 г рідкої води з 2 г водню і 16 г кисню виділяється 285,8 кДж енергії у вигляді теплоти.
А. Л. Лавуазьє і П. С. Лаплас довели, що теплота розкладання даної сполуки чисельно дорівнює теплоті її утворення, але має протилежний знак — це перший закон термохімії. З цього закону випливає, що чим більше теплоти виділяється під час утворення тієї чи іншої сполуки, тим більше теплоти слід затратити на її розкладання.
Слід розрізняти поняття «стандартні умови», що включає стандартну температуру (25 °С) і тиск (101 кПа), і «стандартний стан речовини» — за тиску 101 кПа і будь-якої сталої температури.
Визначені для речовин, що перебувають у стандартному стані, стандартні значення ентальпії та інших термодинамічних величин позначають відповідним символом з індексом зверху H0, а індексом знизу символа зазначають температуру, за якої вони визначені. Наприклад, зміна ентальпії H0298 визначена за температури 298 К, зміна ентальпії H01000 — за температури 1000 К.
Стандартна ентальпія утворення речовини H0f — це зміна ентальпії в процесі утворення даної речовини, що перебуває в стандартному стані з термодинамічно стабільних форм простих речовин, що також перебувають у стандартних станах. Стандартні теплоти утворення відомі для багатьох речовин, вони зведені в таблиці (табл. 1).
Теплоти утворення простих речовин, стійких за стандартних умов (графіт, ромбічна сірка, кристалічний йод тощо), приймають такими, що дорівнюють нулю. В термохімічних рівняннях зазначають стан речовини: (к) — кристалічний, (р) — рідкий, (г) — газоподібний. Термохімічне рівняння реакції утворення води в рідкому стані можна записати так:
Н2 (г) + 1/2О2 (г) = Н2О (р), ∆H = –285,8 кДж.
Теплота утворення водяної пари становить –241,8 кДж/моль; відповідне термохімічне рівняння має вигляд:
Н2 (г) + 1/2О2 (г) = Н2О (г), ∆H = –241,8 кДж.
Таблиця 1. Стандартні ентальпії утворення деяких речовин і йонів
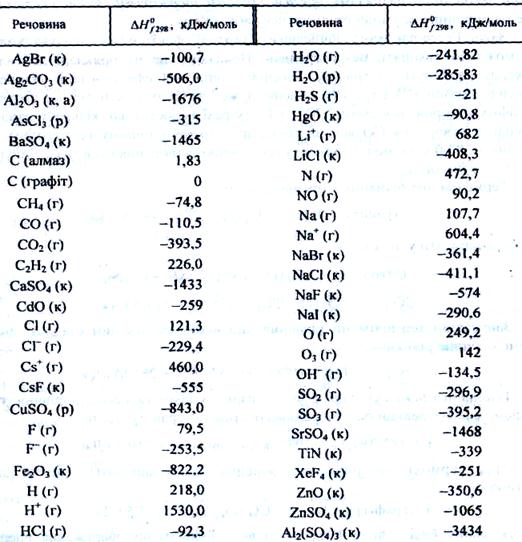
|
Різниця між теплотами утворення води в рідкому (–285,8 кДж/моль) і пароподібному стані (–241,8 кДж/моль) є теплотою випаровування 18 г (1 моль) води за температури 25 °С.
Теплота утворення оксиду нітрогену(П) дорівнює +90,25 кДж/моль, тому відповідне термохімічне рівняння матиме вигляд:
1/2N2 (г) + 1/2О2 (г) = NO (г), ∆H = 90,25 кДж.
Це означає, що під час утворення 1 моль газоподібного оксиду нітрогену(ІІ) з 0,5 моль газоподібного азоту і 0,5 моль газоподібного кисню поглинається 90,25 кДж теплоти.
Важливою характеристикою речовин, що застосовуються як паливо, є їхня питома теплота згоряння, яку теж прийнято визначати відносно 1 моль речовини. З термохімічного рівняння
С2Н2 (г) + 21/2О2 (г) = Н2О (р) + 2СО2 (г), ∆H = –1300 кДж
видно, що теплота згоряння одного моля ацетилену дорівнює 1300 кДж.
Величина теплового ефекту залежить від природи вихідних речовин і продуктів реакції, від їх агрегатного стану, а також від температури і тиску.
Оскільки більшість хімічних реакцій проводять за сталого тиску, основну увагу ми приділятимемо ізобарним процесам.
Для визначення теплових ефектів застосовують прилади калориметри.
В основі термохімічних розрахунків лежить закон, відкритий російським ученим Г. І. Гессом у 1840 р. Цей закон формулюється так: тепловий ефект реакції залежить тільки від початкового та кінцевого станів вихідних речовин та продуктів реакції і не залежить від проміжних стадій процесу. Цей закон іноді називають другим законом термохімії. Закон Гесса справедливий лише за умови сталого тиску або об'єму.
Закон Гесса дає змогу обчислювати теплові ефекти в тих випадках, коли їх неможливо виміряти безпосередньо. Покажемо це на прикладі добування карбон(ІІ) оксиду з графіту. Виміряти тепловий ефект реакції утворення карбон(ІІ) оксиду з графіту і кисню дуже важко, оскільки під час згоряння графіту утворюється суміш СО + СО2 (у разі недостатньої кількості кисню). Теплоту утворення СО можна обчислити, знаючи теплоту (ентальпію) згоряння (–283,0 кДж/моль) і теплоту (ентальпію) утворення карбон(ІV) оксиду (–393,5 кДж/моль).
Термохімічне рівняння згоряння графіту
С (графіт) + О2 (г) = СО2 (г), ∆H = –393,5 кДж
можна записати у дві стадії:
С (графіт) + 1/2О2 (г) = СО (г), ∆H = х кДж;
СО (г) + 1/2O2 (г) = СО2 (г), ∆H = –283,0 кДж.
Записавши термохімічні рівняння, що відповідають цим стадіям, дістанемо сумарне рівняння:
С (графіт) + О2 (г) = СО2 (г), ∆H = (х + 283,0) кДж.
Тепловий ефект сумарної реакції (згідно з законом Гесса) дорівнює тепловому ефекту реакції безпосереднього згоряння графіту, тобто
(х + 283,0) кДж = 393,5 кДж, звідки х = 110,5 кДж.
Отже, термохімічне рівняння утворення карбон(ІІ) оксиду можна записати так:
С (графіт) + 1/2О2 (г) = СО (г), ∆H = –110,5 кДж.
Із закону Гесса, який є одним із висновків закону збереження енергії, випливає два важливих наслідки: 1) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот утворення ∆Hf продуктів реакції з відніманням суми стандартних теплот утворення вихідних речовин; 2) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот згоряння ∆HЗ вихідних речовин з відніманням суми стандартних теплот згоряння продуктів реакції. Перший наслідок має загальне значення, другий важливий для органічних сполук.
Так, для реакції взаємодії газоподібного SО3 і кристалічного Аl2О3
Аl2О3 (к) + 3SО3(г) = Аl2(SО4)3 (к)
тепловий ефект реакції визначається залежністю
∆H = ∆H0f Аl2(SО4)3 – (∆H0f Аl2О3 + 3∆H0f SО3).
Згідно з даними табл. 1, тепловий ефект цієї реакції становить
∆H = –3434 – (–1675 –3 ∙ 395,2) = –753,3 кДж.
За законом Гесса розраховано стандартні теплоти утворення багатьох сполук. Крім цього, за законом Гесса обчислені теплові ефекти хімічних реакцій без проведення спеціальних досліджень. Закон Гесса відіграв велику роль у розвитку не тільки термохімії, а й більш широкої галузі науки — хімічної термодинаміки.
Читайте також:
- Аналогія величин і рівнянь поступального і обертального руху. Кінетична енергія обертання тіла
- Важливим параметром конденсаторів є пробивна напруга конденсатора. Чим вона більша, тим надійніший конденсатор, тим більша енергія може сконцентруватись на ньому.
- Власна енергія зарядів.
- Внутрішня будова довгастого мозку
- Внутрішня будова мосту
- Внутрішня будова спинного мозку
- Внутрішня будова спинного мозку
- Внутрішня будова твердої речовини
- Внутрішня громадськість та імідж організації.
- Внутрішня енергія реального газу
- Внутрішня енергія реального газу
- Внутрішня енергія системи
| <== попередня сторінка | | | наступна сторінка ==> |
| Комплексний зв’язок | | | Ентропія, енергія Гіббса та напрямленість процесів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |