
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ЯВИЩЕ ОСМОСУ. ЗАКОН ВАНТ - ГОФФА
Одностороння дифузія розчинника через напівпроникну мембрану в зону з більшою концентрацією називається осмосом.
Об'єм розчину в результаті осмосу збільшується, при цьому виникає тиск на стінки посудини, в якому знаходиться розчин. Цей тиск називається осмотичним. Осмотичний тиск можна виміряти за допомогою приладу - осмометра. Основною частиною осмометра єпосудина 1 з напівпроникного матеріалу 3, який заповнюється розчином 2 і розташовується в ємкості 4 з розчинником. В результаті осмосу об'єм 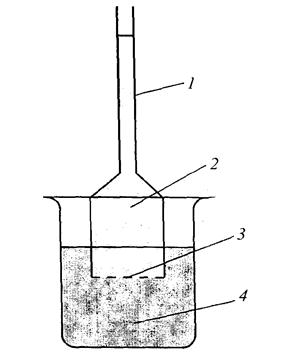 розчину в посудині 1 буде збільшуватися і він почне підніматися повертикальній трубці. Тиск стовпа рідини (гідростатичний тиск) що визначається висотою h, перешкоджає осмосу.
розчину в посудині 1 буде збільшуватися і він почне підніматися повертикальній трубці. Тиск стовпа рідини (гідростатичний тиск) що визначається висотою h, перешкоджає осмосу.
Коли гідростатичний тиск вирівнюється з осмотичним тиском настає рівновага. По висоті підйому рідини в трубці можна розрахувати гідростатичний тиск, що дорівнює в даному випадку осмотичному тиску.
Осмотичний тиск залежить від концентрації розчину і температури.
Рис.7. Схема осмометра:
1 – манометр; 2 – розчин; 3 – напівпроникна перегородка; 4 – розчинник.
Для розбавлених розчинів неелектролітів ця залежність виражається рівнянням Вант-Гоффа.
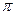 =
= 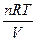 = CRT, бо С = n/v
= CRT, бо С = n/v
де: 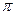 - осмотичний тиск, Па;
- осмотичний тиск, Па;
n - кількість розчиненої речовини ( моль);
Т- абсолютна температура;
V - об'єм розчину;
R - постійна, прийнята рівною універсальній газовій сталій;
R = 8,314 • 103 Дж/(моль∙К).
Відповідність рівняння Вант—Гоффа по формі з рівнянням стану ідеального газу Клапейрона - Менделєєва дозволило зробити висновок, що осмотичний тиск розбавленого розчину дорівнює тому тиску, який необхідно прикласти до розчину, щоб привести його в рівновагу з чистим розчинником, що відокремлений від нього напівпроникною перегородкою. Цей висновок і є законом Вант-Гоффа. Закон Вант-Гоффа справедливий не для всіх розчинів. Розчини електролітів (солей, кислот, основ) мають більш високий осмотичний тиск, ніж розрахований за рівнянням Вант-Гоффа.
Читайте також:
- II. Закон кийка та ікла
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- III закон Ньютона
- IV. Закони ідеальних газів.
- IV. Закономірності структурно-функціональної організації спинного мозку
- IV. СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ І ЗАКОНОДАВСТВА.
- А) Грошовий обіг. Закони.
- Або зі зберігання інформації та забезпечення доступу до неї, за умови, що ця особа не могла знати про незаконність розповсюдження інформації.
- Авілум – “син чоловіка” – повноправна людина, охороні його життя, здоров’я, захисту його майнових інтересів присвячена значна частина законника.
- Агностицизм, сторонники которого отрицают возможность достоверного познания сущности материального мира, закономерностей развития природы и общества.
- Аграрне право та законодавство США, Німеччини, Франції, Великої Британії, Ізраїлю, Польщі, Росії
- Аграрні закони України
| <== попередня сторінка | | | наступна сторінка ==> |
| Концентрація насиченого розчину будь-якої речовини при даній температурі постійна і характеризує розчинність цієї речовини. | | | Розчини, що мають однаковий осмотичний тиск, називають ізотонічними. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |