
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Концентрація насиченого розчину будь-якої речовини при даній температурі постійна і характеризує розчинність цієї речовини.
При певних умовах можна одержати розчини, концентрація яких вища концентрації насиченого розчину. Такі розчини називаються перенасиченими.
Розчин називається перенасиченим, коли в ньому міститься значно більше розчиненої речовини, ніж її потрібно для насичення при даній температурі.
Вони досить нестійкі і при перемішуванні, струшуванні або попаданні них твердих частинок (пил тощо) розділяються на осад розчиненої речовини і насичений розчин. У спокійному стані вони можуть роками залишатися без змін.
Швидкість розчинення твердої речовини залежить від розміру частинок – великі шматки твердої речовини слід подрібнювати в ступці. Проте гігроскопічні речовини не подрібнюють перед розчиненням. Якщо порошок при висипанні у воду спливає і не змочується, то його слід спочатку змочити етиловим спиртом, а потім додавати у воду. Смолисті речовини перед розчиненням слід розрізати на невеликі шматочки і вводити до розчинника поступово.
Розчинення твердих речовин супроводжується поглинанням або виділенням теплоти, яку відносять до 1молю розчиненої речовини. Різниця в знаках теплового ефекту розчинення пояснюється тим, що при розчиненні твердих речовин в рідині одночасно йдуть два процеси – взаємодія молекул розчинника з молекулами або іонами твердої речовини (сольватація) або при розчиненні у воді (гідратація) та руйнування твердої речовини з розподіленням її по всьому об’єму розчину. При сольватації енергія виділяється (ΔН1< 0), на руйнування твердої речовини енергія витрачається (ΔН2 > 0). Сумарний тепловий ефект залежить від абсолютних значень ΔН1 та ΔН2 і може бути як позитивний, так і від’ємним.
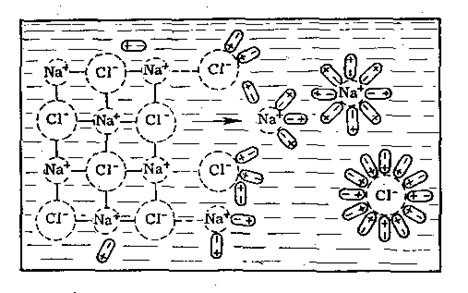
Рис.5. Схема розчинення кристалів солі NaCl у воді
Сольватацію можна розглядати на прикладі розчинення кристалів солі NaCl у воді (рис.5). Диполі води орієнтуються навкруги від’ємних іонів хлору своїм позитивним полюсом, а навкруги позитивних іонів натрію – від’ємним, тобто відбувається гідратація іонів. В результаті цього процесу зв’язок між поверхнево розташованими іонами в кристалі хлористого натрію послаблюється. Іони натрію і хлору відриваються від кристалу, а молекули води утворюють навкруги них так звану гідратну оболонку.
Процес розчинення у воді NaCl практично не має теплового ефекту, бо енергія гідратації майже дорівнює енергії руйнування кристалу.
При розчиненні у воді КСl з досить стійкою кристалічною граткою, іони К+ і Сl- гідратуються і енергія ΔН1, що виділяється при цьому, компенсує більшу частину енергії ΔН2, необхідної для руйнування кристалічної гратки. Отже, за абсолютним значенням ΔН2 >ΔН1 і при розчиненні КСl у воді теплота буде поглинатися з оточуючого середовища, тобто цей процес ендотермічний.
Розчинність кристалогідрату CuCl2∙2H2O супроводжується виділенням теплоти, тобто процес екзотермічний, бо енергія гідратації значно перевищує енергію руйнування твердого тіла.
Знак теплового ефекту визначає і вплив температури на розчинність. Процес розчинення більшості твердих речовин ендотермічний і з підвищенням температури розчинність збільшується.
Для деяких речовин з підвищенням температури розчинність зменшується, оскільки процес їх розчинення екзотермічний.
Розчинність твердих речовин завжди обмежена. Але абсолютно нерозчинних речовин в природі не існує, хоча і є речовини, практично не розчинні у воді. До них можна віднести BaSO4, CaCO3, CuS, AgCl та інші.
Як і будь-який фізико-хімічний процес, процес розчинення підкоряється певним закономірностям. Відомо, що швидкість хімічних процесів залежить від температури. Аналогічно, швидкість розчинення речовин при підвищенні температури збільшується, отже, збільшується і розчинність.
На швидкість розчинення впливають дифузія та ступінь подрібнення речовини. Швидкість переходу речовини з кристала в розчин, тобто швидкість гідратації, на два порядки більша, ніж швидкість дифузії гідратованої молекули (чи іона) у глибину розчину. Тому для того, щоб збільшити швидкість розчинення, розчин необхідно перемішувати. При цьому збільшується швидкість дифузії гідратованих частинок у розчин. Оскільки процес розчинення відбувається лише на поверхні розподілу фаз, то чим більшою є ступінь подрібнення речовин, тим більшою є його питома поверхня і, отже, вищою є швидкість розчинення.
4. ДИФУЗІЯ І ОСМОС В РОЗЧИНАХ. ЗАКОН ВАНТ-ГОФФА
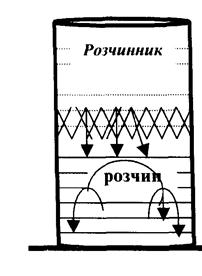
Якщо в стакан із зафарбованим розчином якої-небудь речовини обережно влити розчинник, то на початку між шарами розчину і розчинника буде спостерігатися чітка межа розподілу.
Поступово межа розділу розмивається і через деякий час весь об'єм рідини набуває рівномірного зафарбування. Це відбувається в наслідок дифузії.
Дифузія - самовільний переніс рідини з області з більшою концентрацією в область з меншою концентрацією, або іншими словами це самовільний процес вирівнювання концентрацій.
В наведеному прикладі розчинена речовина з нижнього шару дифундує в шар чистого розчинника, а молекули розчинника переходять в шар розчину, де концентрація їх менше. Цей процес двосторонньої дифузії закінчиться вирівнюванням концентрації в усьому об'ємі.
 Швидкість дифузії вимірюється кількістю речовини, що переноситься за одиницю часу через одиницю площі.
Швидкість дифузії вимірюється кількістю речовини, що переноситься за одиницю часу через одиницю площі.
Рис. 6. Процес дифузії через мембрану
Вона пропорційна різниці концентрації в двох шарах рідини і температурі. Чим більша різниця концентрації і чим вища температура, тим швидкість дифузії більша. По мірі вирівнювання концентрації швидкість дифузії зменшується.
Дифузія може йти в тому випадку, якщо між шаром розчину і шаром розчинника помістити напівпроникну перегородку - мембрану. Напівпроникними перегородками для водних розчинів можуть бути природні плівки, стінки клітин, а також плівки, одержані штучним шляхом (целофан, пергамент). Через ці плівки можуть проходити молекули розчинника і не проходять молекули розчиненої речовини. Такі плівки називаються напівпроникними мембранами.
Дифузія відіграє значну роль в життєдіяльності організмів і технологічних процесах. Так, процес переміщення різних поживних речовин і продуктів обміну в живих організмах пов’язаний з дифузією. В технології харчування з дифузією мають справу при вимочуванні риби, заварюванні чаю, кави. Такі процеси як варка, пасерування, припускання також є практичним застосуванням дифузії.
Читайте також:
- IV. Запасні речовини
- Абсорбція лікарської речовини в організмі.
- Агрегатні стани речовини
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
- Азотисті речовини
- Аморфний та кристалічний стан твердої речовини.
- Аналіз розчину з осадом
- Атомарний рівень будови речовини
- Атомно-молекулярна будова речовини.
- Барвні речовини
- Барвні речовини
- Безрецептурні препарати при високій температурі
| <== попередня сторінка | | | наступна сторінка ==> |
| РОЗЧИННІСТЬ ТВЕРДИХ РЕЧОВИН В РІДИНАХ | | | ЯВИЩЕ ОСМОСУ. ЗАКОН ВАНТ - ГОФФА |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |