
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Атомно-молекулярна будова речовини.
Абсолютна температура.
Атомно-молекулярна будова речовини.
2. Статистичний та термодинамічний методи дослідження.
3. Рівняння стану ідеального газу.
4. Кінетична енергія молекул, її розподіл по ступенях свободи.
Молекулярна фізика – розділ фізики, в якому вивчають будову і властивості речовини в різних агрегатних, виходячи з молекулярно-кінетичних уявлень про те, що усі тіла складаються з атомів, молекул або іонів, які перебувають у неперервному тепловому русі.
Теорію, яка пояснює будову і властивості тіл на основі закономірностей руху і взаємодії молекул, називають молекулярно-кінетичною теорією.
Значний внесок у створення МКТ зробили: Лавуаз'є, Ломоносов, Больцман (друга половина ХІХ ст.).
Молекулярно-кінетична теорія (МКТ) речовини базується на чотирьох положеннях, що підтверджуються дослідами:
1) усі тіла мають дискретну (переривчасту) будову, вони складаються зі структурних елементів (атомів, молекул чи іонів) – підтвердженням дискретності є прокатка або кування металу, розчинність речовин зображення окремих молекул, отримані за допомогою іонного проектора, електронного мікроскопа тощо;
Молекула – найменша частинка речовини, яка зберігає усі її хімічні властивості і складається з атомів.
А́том (з давньогрецької ἄτομος – неподільний) – найменша хімічно неподільна частинка хімічного елементу, що є носієм його властивостей.
Іон (з грец. ιόν — «той, що йде») — електрично заряджена частинка речовини, що утворилася з атома або молекули внаслідок втрати або приєднання до них електронів.
У природі є 92 хімічні елементи, разом із штучними наразі налічують 117 елементів (у 2010 році синтезовано Uus Унунсе́птий).
2) структурні елементи здійснюють неперервний хаотичний рух, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів – підтвердженням є спостереження броунівського руху, явища дифузії, осмосу.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
Броун 1827 року відкрив хаотичний рух спори плауна у воді. Рух завислих частинок відбувався внаслідок руху молекул. Такого ж руху зазнають частинки фарби у воді, пилинки у промені світла тощо. Молекули передають частинкам не скомпенсований імпульс, а отже, чинять на частинки тиск, тому частинка здійснює безладний рух в об'ємі рідини чи газу.
Приклад дифузії в газах – виникнення запаху, у рідинах – переміщування рідин різної густини. Молекули золота і свинцю внаслідок дифузії протягом 5 років утворюють шар завтовшки 1 см. З підвищенням температури швидкість дифузії зростає. У природі дифузія сприяє живленню рослин з ґрунту. Без дифузії життя було б неможливим, адже насичення крові киснем і відведення шкідливих речовин – теж дифузія.
Дифузію, що відбувається через напівпроникні перегородки, називають осмосом.
3) між структурними елементами існують сили взаємного притягання і відштовхування – пружні властивості тіл.
У рівноважному стані молекули або атоми речовини знаходяться на відстанях, на яких сили відштовхування і притягання переважно скомпенсовані. Якщо зовнішні сили прагнуть віддалити молекули, то переважаючими стають сили притягання (протидія розтягові тіл). Якщо, навпаки, зовнішні сили прагнуть наблизити молекули, то переважаючими стають сили відштовхування (протидія стисненню).
4) структурні елементи мають власний розмір і масу – поведінка реальних газів, особливо за високих тисків.
2. Статистичний та термодинамічний методи дослідження.
Механічний або динамічний метод, що широко використовується у механіці, для дослідження поведінки систем з великою кількістю частинок не підходить.
Оскільки неможливо визначити положення і швидкості усіх молекул у певний момент часу, а також розрахувати положення і швидкості молекул у попередній або наступний моменти часу за відомими з механіки законами їх руху та взаємодії, через малі розміри молекул і їх значну кількість у довільному макроскопічному тілі.
Для дослідження макроскопічнихпроцесів, що протікають у тілах, які складаються з великої кількості структурних елементів, застосовують два якісно відмінні методи: статистичний (молекулярно-кінетичний) і термодинамічний.
Молекулярно-кінетична теорія має на меті пояснити властивості тіл, що безпосередньо спостерігаються на досліді (тиск, температуру тощо), як сумарний ефект дії молекул.
Властивості величезного скупчення молекул, що утворюють тіло, підлягають особливим статистичним закономірностям і їх можна вивчити за допомогою статистичного методу, який ґрунтується на тому, що властивості макроскопічної системи визначаються властивостями частинок системи, особливостями їх руху і усередненими значеннями динамічних характеристик цих частинок (швидкості, енергії тощо).
Існує певний якісний і кількісний зв’язок між властивостями сукупності молекул і середніми значеннями тих фізичних властивостей, які характеризують поведінку та властивості кожної молекули окремо. Наприклад, температура газу пов’язана із середнім значенням кінетичної енергії молекул. Для встановлення цього зв’язку не потрібно точно знати положення або швидкість кожної молекули, а досить знати їх ймовірні значення.
Введення середніх значень величин у молекулярній фізиці зумовлене не лише тим, що не можна стежити за рухом кожної молекули окремо через велику їх кількість, а й тим, що сукупність величезної кількості молекул дає нові властивості, яких немає в кожної молекули окремо і підлягає новим статистичним законам.
Статистичний (молекулярно-кінетичний) метод пов’язаний з тим, що властивості макросистеми (об’єм, тиск, температура, маса тіла, внутрішня енергія газу) у кінцевому порядку визначаються властивостями частинок системи, їх особливостями руху і середніми, тобто статистичними, значеннями параметрів (середня квадратична швидкість руху молекул, середня енергія молекул).
Термодинаміка – розділ фізики, що вивчає загальні властивості макроскопічних систем, що знаходяться в стані термодинамічної рівноваги, і процеси переходу між цими станами.
На основі термодинамічного методу вивчають умови перетворення
енергії з одного виду в інший та встановлюють кількісні співвідношення між ними (кількістю теплоти, роботою, внутрішньою енергією). В основі термодинаміки лежать три експериментально встановлені закони, які називають першим, другим і третім законами термодинаміки. Термодинамічний метод не досліджує мікроскопічної будови речовини, механізм явищ, а лише встановлює зв’язок між макроскопічними властивостями речовини.
3. Рівняння стану ідеального газу.
Термодинамічною системою називають усяку фізичну систему, що складається з великого числа структурних елементів – атомів, молекул чи іонів, які здійснюють невпорядкований тепловий рух і, взаємодіючи між собою, обмінюються енергією.
Рівнянням стану термодинамічної системи називають рівняння, що пов’язує основні макропараметри – об’єм 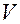 , тиск
, тиск 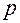 і температуру Т термодинамічної системи, яка знаходиться у стані термодинамічної рівноваги:
і температуру Т термодинамічної системи, яка знаходиться у стані термодинамічної рівноваги:
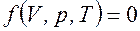 .
.
Для пояснення властивостей речовини в газоподібному стані та спрощення встановлення законів МКТ газів вводять поняття ідеального газу.
Ідеальний газ – модель реального газу, в якому не враховують об’єм молекул та нехтують їх взаємодією, а також вважають, що зіткнення молекул газу між собою і з стінками посудини абсолютно пружні.
У природі такого газу не існує, але близькими за властивостями можна вважати реальні гази за нормальних умов, а також при низьких тисках і високих температурах.
Параметри p, V і T для ідеального газу поєднані співвідношенням, яке дозволяє описати перехід системи з одного стану в інший:
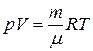 – рівняння Менделєєва-Клапейрона,
– рівняння Менделєєва-Клапейрона,
де p – тиск, V – об’єм газу, T – температура, m – маса газу, μ – молярна маса газу, R – універсальна газова стала 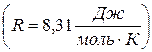 .
.
4. Кінетична енергія молекул, її розподіл по ступенях свободи.
Для того, щоб визначити енергію, яка припадає на всі рухи молекул, необхідно ввести поняття про число ступенів вільності.
 Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
 Матеріальна точка, що довільно рухається у просторі, має три ступені вільності (x, y, z). Якщо ця точка рухається по деякій поверхні або вздовж певної кривої, то вона відповідно має два або один ступені вільності.
Матеріальна точка, що довільно рухається у просторі, має три ступені вільності (x, y, z). Якщо ця точка рухається по деякій поверхні або вздовж певної кривої, то вона відповідно має два або один ступені вільності.
Абсолютно тверде тіло має 6 ступенів вільності – 3 ступені вільності поступального руху і 3 ступені вільності обертального руху.
Якщо тіло не абсолютно тверде і його частини можуть зміщуватись одна відносно одної, то вводять ще додаткові ступені вільності коливального руху.
Маса молекули одноатомного газу зосереджена в ядрі, розміри якого дуже малі. Таку молекулу можна розглядати як матеріальну точку (див. рис.).
Молекула одноатомного газу має 3 ступені свободи поступального руху.
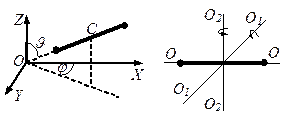 Молекула двоатомного газу в першому наближенні – це два жорстко зв’язані атоми, що перебувають на деякій відстані один від одного. Окрім поступального руху вздовж трьох напрямків, молекула двоатомного газу буде ще здійснювати обертання навколо осей
Молекула двоатомного газу в першому наближенні – це два жорстко зв’язані атоми, що перебувають на деякій відстані один від одного. Окрім поступального руху вздовж трьох напрямків, молекула двоатомного газу буде ще здійснювати обертання навколо осей 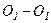 і
і 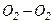 (див. рис.). Обертання навколо третьої осі
(див. рис.). Обертання навколо третьої осі 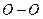 розглядати не треба, бо момент інерції атомів відносно цієї осі дуже малий.
розглядати не треба, бо момент інерції атомів відносно цієї осі дуже малий.
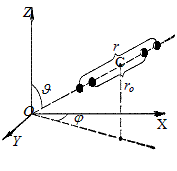 Якщо два атоми зв’язані не жорстким зв’язком, а пружним, то
Якщо два атоми зв’язані не жорстким зв’язком, а пружним, то 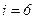 . Положення системи в цьому випадку можна визначити, якщо задати три координати центра мас, два кути
. Положення системи в цьому випадку можна визначити, якщо задати три координати центра мас, два кути 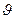 і
і 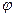 і відстань між атомами r (рис.). Зміна r відповідає коливанням в системі, внаслідок чого цей ступінь вільності називається коливним.
і відстань між атомами r (рис.). Зміна r відповідає коливанням в системі, внаслідок чого цей ступінь вільності називається коливним.
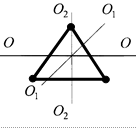 Жорстка молекула двоатомного газу має 3 ступені свободи поступального руху і 2 ступені свободи обертального руху, якщо атоми в молекулі зв’язані не жорстким зв’язком, то ще 1 ступінь свободи коливального руху.
Жорстка молекула двоатомного газу має 3 ступені свободи поступального руху і 2 ступені свободи обертального руху, якщо атоми в молекулі зв’язані не жорстким зв’язком, то ще 1 ступінь свободи коливального руху.
Триатомна і багатоатомні нелінійні молекули (див. рис.) мають 6 ступенів свободи – 3 поступальних і 3 обертальних. Жорсткого зв’язку між атомами не існує. Тому для реальних молекул необхідно враховувати також ступені вільності коливального руху.
| Кількість ступенів свободи | Одноатомний газ | Двоатомний газ | Багатоатомний газ | |||

| ||||||
| Жорсткі молекули | Не жорсткі молекули | Жорсткі молекули | Не жорсткі молекули | Жорсткі молекули | Не жорсткі молекули | |
| Поступ. | ||||||
| Оберт. | - | - | ||||
| Колив. | - | - | - | - | ||
| Усього |
У класичній статистичній фізиці виводиться закон Больцмана про рівномірний розподіл енергій за ступенями вільності молекул: для статистичної системи, що перебуває у стані термодинамічної рівноваги, на кожний поступальний і обертальний ступінь вільності припадає в середньому кінетична енергія, що дорівнює 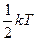 , а на кожний коливальний ступінь вільності – в середньому енергія
, а на кожний коливальний ступінь вільності – в середньому енергія 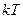 .
.
Таким чином, середня енергія молекули:
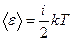 ,
,
де
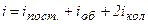 .
.
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- Аморфний та кристалічний стан твердої речовини.
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
- АСОЦІАЦІЯ. ПОБУДОВА АСОЦІАТИВНОГО КУЩА
- Атмосфера. ЇЇ хімічний склад та будова
- Базис і надбудова.
- Біоелектричні явища в тканинах: будова мембран клітини, транспорт речовин через мембрану, потенціал дії та його розповсюдження.
- Бризантні вибухові речовини.
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Теплота та робота. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |