
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Теплота та робота.
Теплота та робота.
2. Внутрішня енергія системи як функція стану.
3. Перше начало термодинаміки.
4. Термодинамічні діаграми.
5. Ізопроцеси в газах.
6. Адіабатний процес.
7. Теплоємність газів.
Термодинаміка – розділ фізики, що вивчає загальні властивості макроскопічних систем, що знаходяться в стані термодинамічної рівноваги, і процеси переходу між цими станами.
Термодинаміка розглядає системи, для яких механічна енергія не змінюється, а змінюється лише їх внутрішня енергія. Тобто беруться до уваги дві форми передавання енергії від одного тіла до іншого, а, отже, і зміни внутрішньої енергії системи – робота та теплота.
Перша з них зводиться до того, що енергія впорядкованого руху одного тіла переходить в енергію впорядкованого руху іншого тіла або його частин. Це може відбуватись під час взаємодії макроскопічних тіл, розміри яких у багато разів більші за розміри окремих атомів або молекул. Таку форму передавання енергії називають роботою.
Наприклад, газ, що розширюється в циліндрі двигуна внутрішнього згоряння, переміщує при цьому поршень і передає йому енергію у формі роботи.
Робота – форма передачі енергії під час взаємодії макроскопічних тіл, розміри яких у багато разів більші за розміри окремих атомів або молекул, при цьому енергія впорядкованого руху одного тіла переходить в енергію впорядкованого руху іншого тіла або 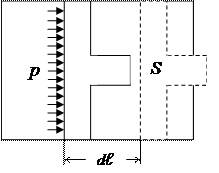 його частин.
його частин.
Якщо під дією сили тиску поршень переміститься на відстань  , то робота, яку виконує газ, що знаходиться під поршнем при тиску
, то робота, яку виконує газ, що знаходиться під поршнем при тиску 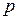 (рис.) буде визначена як:
(рис.) буде визначена як:
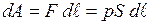 ,
,
де  – зміна об’єму газу.
– зміна об’єму газу.
Тоді:
 або
або  .
.
Друга форма передавання енергії здійснюється при безпосередньому обміні енергією між частинками взаємодіючих тіл, що рухаються хаотично. За рахунок переданої тілу енергії підсилюється невпорядкований рух його частинок, тобто збільшується внутрішня енергія тіла. Таку форму передавання енергії в термодинаміці називають теплотою.
Так, наприклад, при дотику холодного тіла і гарячого молекули другого тіла, які швидко рухаються, стикаються з молекулами першого тіла, що рухається повільніше, і передають їм частину своєї кінетичної енергії. Внаслідок цього внутрішня енергія першого тіла збільшується, другого – зменшується, а їх температури вирівнюються.
Теплота – це вид енергії, який передається від одного тіла до другого під час теплового контакту, при цьому підсилюється невпорядкований рух частинок менш нагрітого тіла, тобто збільшується його внутрішня енергія.
Кількість теплоти при нагріванні або охолодженні  тіла визначають формулою:
тіла визначають формулою:
 ,
,
де  – питома теплоємність речовини, з якої виготовлене тіло,
– питома теплоємність речовини, з якої виготовлене тіло,
 – маса тіла,
– маса тіла,
 – зміна температури тіла.
– зміна температури тіла.
Найбільшу теплоємність з будівельних матеріалів має дерево – 2,3 кДж/(кг·°С), найменшу сталь і мідь – 0,42 кДж/(кг·°С). Теплоємність повітря при температурі +20°С становить 1,005 кДж/(кг·°С), теплоємність води 4,183 кдж/(кг·°С).
Теплота і робота є формою передавання енергії, а зовсім не видом енергії.
Між теплотою і роботою існує глибока якісна відмінність. Теплота і робота є нерівноцінними формами передавання енергії впорядкованого руху. Виконання роботи над системою може безпосередньо привести до збільшення будь-якого виду енергії системи (кінетичної, потенціальної, внутрішньої).
Надання системі (або тілу) теплоти, тобто збільшення енергії хаотичного теплового руху її частинок безпосередньо приводить тільки до збільшення внутрішньої енергії.
Для того, щоб при підведенні до системи теплоти зросла енергія інших видів, крім внутрішньої, необхідно хоч би частково перетворити хаотичний рух частинок в упорядкований або перетворити теплоту в роботу.
Теплота і робота тісно пов’язані між собою. Обидві ці форми передавання енергії переходять одна в одну і в реальних умовах супроводять одна одну. Так, наприклад, при нагріванні металевого стрижня не тільки збільшується його внутрішня енергія, а відбувається також розширення стрижня і, отже, виконується робота розширення. Досліди показали, що теплота перетворюється в роботу, або робота в теплоту завжди в точно відповідних кількостях, незалежно від способу перетворення.
2. Внутрішня енергія системи як функція стану.
Однією з основних характеристик термодинамічної системи є внутрішня енергія.
Під внутрішньою енергією системи розуміють суму кінетичних енергій руху всіх молекул (атомів) газу і потенціальних енергій взаємодії між ними.
Внутрішня енергія ідеального газу буде складатися лише з суми кінетичних енергій теплового руху молекул (атомів) газу:
 .
.
Середня кінетична енергія руху однієї молекули:
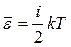 ,
,
тоді для одного моля газу, який містить  молекул, внутрішня енергія становитиме:
молекул, внутрішня енергія становитиме:
 або
або  ,
,
оскільки  .
.
Внутрішня енергія довільної кількості газу:
 ,
,
де  – маса газу;
– маса газу;
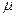 – молярна маса газу,
– молярна маса газу,  ;
;
 – кількість речовини,
– кількість речовини, 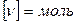 .
.
3. Перше начало термодинаміки.
Дослід показує, що відповідно до закону збереження енергії при довільному способі переходу системи з першого стану у другий зміна внутрішньої енергії  дорівнюватиме різниці між кількістю теплоти Q, отриманою системою, і роботою A, яка виконана системою проти зовнішніх сил:
дорівнюватиме різниці між кількістю теплоти Q, отриманою системою, і роботою A, яка виконана системою проти зовнішніх сил:  , або
, або 
Перше начало термодинаміки: якщо системі передається певна кількість теплоти  , то за законом збереження енергії, вона піде на збільшення внутрішньої енергії газу
, то за законом збереження енергії, вона піде на збільшення внутрішньої енергії газу  (підвищення температури) та на виконання газом роботи
(підвищення температури) та на виконання газом роботи  проти зовнішніх сил:
проти зовнішніх сил:
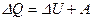
або
 .
.
Вираз для першого закону термодинаміки для нескінченно малої зміни стану системи матиме вигляд:
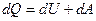
або в коректнішій формі
 ,
,
де  – нескінченно мала зміна внутрішньої енергії системи,
– нескінченно мала зміна внутрішньої енергії системи,
 – нескінченно мала робота,
– нескінченно мала робота,
 – нескінченно мала кількість теплоти.
– нескінченно мала кількість теплоти.
У цьому виразі  є повним диференціалом, а
є повним диференціалом, а  і
і  не є повними диференціалами, а функціоналами і залежать від вигляду функції, що описує перехід з одного стану в другий.
не є повними диференціалами, а функціоналами і залежать від вигляду функції, що описує перехід з одного стану в другий.
Важливим є випадок, у якому система – це періодично діюча машина, в якій газ, пара або інше “робоче тіло” внаслідок деякого процесу повертається у початковий стан, у цьому разі:
 і
і  .
.
Робота, яку виконує машиною за один цикл, дорівнює підведеній ззовні теплоті  . Цей висновок дає змогу дати
. Цей висновок дає змогу дати
друге формулювання першого закону термодинаміки: неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун першого роду неможливий).
4. Термодинамічні діаграми.
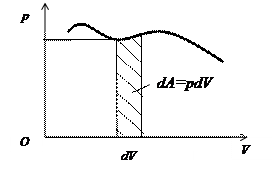 Термодинамічна діаграма – це геометричне зображення рівноважних станів термодинамічної системи при різних значеннях параметрів, які описують дану систему:
Термодинамічна діаграма – це геометричне зображення рівноважних станів термодинамічної системи при різних значеннях параметрів, які описують дану систему: 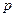 ,
, 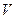 і
і 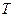 .
.
Будують термодинамічні діаграми у наступних координатах:  ,
, 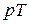 ,
, 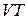 . Найбільш поширеною є
. Найбільш поширеною є  діаграма, оскільки площа під кривою цієї діаграми чисельно дорівнює роботі газу (рис.).
діаграма, оскільки площа під кривою цієї діаграми чисельно дорівнює роботі газу (рис.).
Читайте також:
- IV. Практична робота.
- VI. Домашня робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
| <== попередня сторінка | | | наступна сторінка ==> |
| Атомно-молекулярна будова речовини. | | | Ізопроцеси в газах. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |