
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
В однакових об'ємах різних газів за однакових умов (температура і тиск) міститься однакова кількість молекул.
Із закону Авогадро випливає важливий наслідок: за однакових умов 1 моль будь-якого газу займає однаковий об'єм. Цей об'єм можна обчислити, якщо відома маса 1л газу. За нормальних умов, тобто за температури 273 К (0оС) і тиску 101 325 Па (1 атм), маса 1л водню дорівнює 0,09 г, молярна маса його дорівнює 1,008 2 = 2,016 г/моль. Тоді об'єм, що його займає 1 моль водню, дорівнює:
| За цих самих умов маса 1 л кисню дорівнює 1,429 г; молярна маса — 32 г/моль. Тоді об'єм дорівнює: |
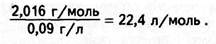 | ||
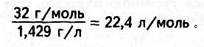 |
Це означає, що за нормальних умов 1 моль різних газів займає об'єм, що дорівнює 22,4 л. Цей об'єм називається молярним об'ємом газу.
 Молярний об'єм газу — це відношення об'єму речовини до кількості цієї речовини:
Молярний об'єм газу — це відношення об'єму речовини до кількості цієї речовини:
де Vm – об'єм газу (позначення одиниці м3/моль або л/моль); V – об'єм речовини системи; n — кількість речовини системи. Приклад запису:
Vm газу (н.у.) ≈ 22,4 л/моль.
У 1860 р. на Міжнародному з'їзді хіміків у м. Карлсруе вчення Авогадро дістало загальне визнання. З'їзд дав сильний поштовх розвитку атомно-молекулярного вчення, який став особливо бурхливим після відкриття Д.І.Менделєєвим періодичного закону хімічних елементів.
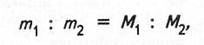 На основі закону Авогадро визначають молярні маси газуватих речовин. Чим більша маса молекул газу, тим більша маса одного й того самого об'єму газу. В однакових об'ємах газів за однакових умов міститься однакове число молекул, а значить, і молів газів. Відношення мас однакових об'ємів газів дорівнює відношенню їх молярних мас:
На основі закону Авогадро визначають молярні маси газуватих речовин. Чим більша маса молекул газу, тим більша маса одного й того самого об'єму газу. В однакових об'ємах газів за однакових умов міститься однакове число молекул, а значить, і молів газів. Відношення мас однакових об'ємів газів дорівнює відношенню їх молярних мас:
де m1 – маса певного об'єму першого газу; m2— маса такого самого об'єму другого газу; М1, М2 — молярні маси відповідно першого і другого газів.
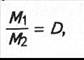 Відношення маси певного об'єму одного газу до маси такого самого об'єму іншого газу (взятого за однакових умов) називається густиною першого газу за другим (позначається літерою D):
Відношення маси певного об'єму одного газу до маси такого самого об'єму іншого газу (взятого за однакових умов) називається густиною першого газу за другим (позначається літерою D):
звідки М1 = М2D.
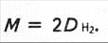 Звичайно густину газу визначають відносно найлегшого газу — водню (позначають DH
Звичайно густину газу визначають відносно найлегшого газу — водню (позначають DH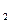 ). Молярна маса водню дорівнює 2,016 г/моль або наближено 2 г/моль. Тому матимемо:
). Молярна маса водню дорівнює 2,016 г/моль або наближено 2 г/моль. Тому матимемо:
Молекулярна маса речовини в газуватому стані дорівнює його подвоєній густині за воднем.
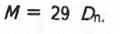 Часто густину газу визначають відносно повітря (Dn). Хоча повітря є сумішшю газів, все ж говорять про його середню молярну масу. Вона дорівнює 29 г/моль. У цьому випадку молярна маса визначається за виразом
Часто густину газу визначають відносно повітря (Dn). Хоча повітря є сумішшю газів, все ж говорять про його середню молярну масу. Вона дорівнює 29 г/моль. У цьому випадку молярна маса визначається за виразом
Визначення молекулярних мас показало, що молекули простих газів складаються з двох атомів (Н2, F2, Сl2, О2, N2), а молекули благородних газів — з одного атома (Не, Ne, Аr, Кr, Хе, Рn). Для благородних газів поняття "молекула" й "атом" рівноцінні. Однак молекули деяких інших простих речовин складаються з трьох і більше атомів, наприклад молекули озону О3, фосфору Р4, пари сірки за невисоких температур S8.
На основі закону Авогадро здійснюють різні розрахунки — обчислення об'єму, маси, густини газів за нормальних умов, молярної маси газуватих речовин, а також відносної густини газів.
в) Закон Бойля –Маріотта;
Для розв'язування розрахункових хімічних задач, пов'язаних з газуватими речовинами, часто доводиться використовувати газові закони, що вивчаються в шкільному курсі фізики. Не розглядаючи їх тут детально, запишемо лише формулювання та формули, необхідні для розрахунків.
 Закон Бойля -Маріотта: за сталої температури об'єм даної кількості газу обернено пропорційний тиску, під яким він перебуває. Звідси
Закон Бойля -Маріотта: за сталої температури об'єм даної кількості газу обернено пропорційний тиску, під яким він перебуває. Звідси
 |
Де р — тиск; V — об'єм газу.
г) Закон Гей-Люссака: за сталого тиску зміна об'єму газу прямо пропорційна температурі, тобто
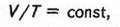 |
де Т — температура в кельвінах (К).
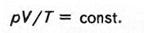 д) Об'єднаний газовий закон Бойля –Маріотта і Гей-Люссака:
д) Об'єднаний газовий закон Бойля –Маріотта і Гей-Люссака:
 Ця формула звичайно застосовується для обчислення об'єму газу за даних умов, якщо відомий його об'єм за інших умов. Якщо здійснюється перехід від нормальних умов (або до нормальних умов), то цю формулу записують так:
Ця формула звичайно застосовується для обчислення об'єму газу за даних умов, якщо відомий його об'єм за інших умов. Якщо здійснюється перехід від нормальних умов (або до нормальних умов), то цю формулу записують так:
 |
де ро, V0, Т0 — відповідно тиск, об'єм і температура газу за нормальних умов (ро = 101 325 Па, То = 273 К).
е) Якщо відома маса або кількість газу, а потрібно обчислити його об'єм, або навпаки, використовують рівняння Менделєєва — Клапейрона:
 |
або
де n — кількість речовини газу, моль; m — маса, г; М — молярна маса газу, г/моль; R — універсальна газова стала. R= 8,31 Дж/моль · К).
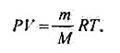 Рівнянням стану ідеального газу — рівнянням Клапейрона—Менделєєва:
Рівнянням стану ідеального газу — рівнянням Клапейрона—Менделєєва:
де Р — тиск газу, Па; V— об'єм газу, м3; т — маса газу, г; М— молярна маса газу, г/моль; Т—абсолютна температура, К; R — універсальна газова стала, що дорівнює 8,31 Дж/(моль · К).
Значення R = 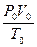 змінюється залежно від одиниць вимірювання тиску та
змінюється залежно від одиниць вимірювання тиску та
об'єму: R = 62 360 мм рт.ст. · мл/(моль· К), якщо тиск вимірюється в міліметрах ртутного стовпа, а об'єм — у мілілітрах; R = 0.082 атм · л/(моль · К), якщо тиск вимірюється в атмосферах, а об'єм — у літрах.
Значення молекулярних мас, визначені цими способами, не зовсім точні, оскільки застосовані для обчислень газові закони і рівняння цілком справедливі лише для розріджених газів. Точніші обчислення роблять на підставі аналізу речовини.
Завдання для самоперевірки:
1. Які ви знаєте газові закони, їх визначення?
2. Прикладний характер вивчення цих законів.
3. Яку масу матиме азот об’ємом 30л за нормальних умов?
4. Який об’єм займатиме за to 20оС і тиску 250кПа аміак масою 51г? (стор. 15 Г.П.Хомченко)
Завдання по перевірці знань студентів з теми «Хімічні поняття і закони»:
а) тестові завдання
| № з/п | Питання | Відповіді | |||
| 1.1.1. Укажіть речення, в яких мова йде про просту речовину: | Фосфор входить до складу ортофосфатної кислоти | Фосфор входить до складу нервових тканин | фосфор, взаємодіючи з киснем, виступає відновником | білий фосфор світиться у темряві | |
| 1.1.2. Укажіть речення, у якому мова йде про хімічний елемент: | кисень розчиняється у воді | Оксисен входить до складу води | кисень підтримує горіння | кисень важчий за повітря | |
| 1.1.3. Укажіть речення, в якому мова йде про хімічний елемент: | азот є складовою частиною повітря | вибухова речовина тротил містить Нітроген | формула азоту N2 | рідкий азот іноді використовується для заморожування продуктів | |
| 1.1.4. Укажіть речення, у яких мова йде про просту речовину: | випади ртуті отруйні | природною сполукою Меркурію є кіновар | ртуть-це рідкий метал | ртуть міститься у медичних термометрах | |
| 1.1.5. Укажіть речення, у якому мова йде про хімічний елемент: | Купрум входить до складу малахіту | дріт зроблено з міді | вміст азоту в повітрі складає 78% (за об’ємом) | усі живі організми на Землі дихають киснем | |
| 1.1.6. Чистою речовиною є: | морська вода | солодкий чай | кухонна сіль | повітря | |
| 1.1.7. Суміш кухонної солі та піску можна розділити за допомогою: | фільтрування | перегонки | послідовних операцій: обробка водою, фільтрування та упарювання розчину | магніту | |
| 1.1.8. До сумішей належать: | кров | кисень | дистильована вода | натрій хлорид | |
| 1.1.9. Фільтруванням можна розділити суміш: | бензину й води | річного піску й води | піску й тирси | рослинної олії й води | |
| 1.1.10. Суміш алюмінієвого та залізного ломів можна розділити за допомогою: | фільтрування | перегонки | послідовних операцій: обробка водою, фільтруванням та упарюванням розчину | магніту | |
| 1.1.11. Чистою речовиною є: | вуглекислий газ | кров | повітря | молоко | |
| 1.1.12. Для розділення суміші води з машинним мастилом може бути використана різниця компонентів за: | кольором | густиною | магнітними властивостями | розміром молекул | |
| 1.1.13. Суміш етилового спирту та води можна розділити за допомогою: | фільтрування | перегонки | послідовних операцій: обробка водою, фільтрування та упарювання розчину | магніту | |
| 1.1.14. У процесі затвердіння води виділяється теплота. Теплота також виділяється у процесі горіння вугілля. Ці явища відповідно: | хімічне та фізичне | фізичне та хімічне | обидва хімічні | обидва фізичні | |
| 1.1.15. Фізичним природним явищем слід вважати: | утворення глюкози в зелених рослинах | лісову пожежу | висихання дощових калюж | процес дихання рослин | |
| 1.1.16. Хімічним природним явищем слід вважати: | вітер | морський приплив | висихання дощових калюж | фотосинтез | |
| 1.1.17. Фізичним природнім явищем слід вважати: | скисання молока | горіння водню | здрібнювання крейди | розклад води під дією електричного струму | |
| 1.1.18. Хімічним явищем слід вважати: | заморожування води | кипіння води | горіння водню | здрібнювання крейди | |
| 1.1.19. До фізичних явищ належить: | утворення льоду | сонячне затемнення | морський прибій | горіння деревини | |
| 1.1.20. До хімічних явищ належить: | горіння сірки | плавлення скла | випадіння снігу | утворення крохмалю в зелених рослинах | |
| 1.1.21. Світіння (горіння) електролампочки та горіння свічки є відповідно явищами: | хімічним та фізичним | фізичним та хімічним | хімічними | фізичними | |
| 1.1.22. Які словосполучення побудовані правильно? | молекула сульфатної кислоти | молекула повітря | іон Хлору | атом малахіту | |
| 4.1.23. Які словосполучення побудовані правильно? | атом Гелію | молекула Гелію | атом Оксигену | молекула кисню | |
| 1.1.24. Які словосполучення побудовані правильно? | молекула оцту | іон Сульфуру | атом спирту | молекула розчину сульфатної кислоти | |
| 1.1.25. Які словосполучення побудовані правильно? | молекула калію | іон Кальцію | атом Цинку | молекула нітратної кислоти | |
| 1.1.26. Які словосполучення побудовані правильно? | молекула сірки | іон Гелію | атом вуглекислого газу | молекула хлоридної кислоти | |
| 1.1.27. Які словосполучення побудовані правильно? | атом оцтової кислоти | іон Барію | атом амоніаку | молекула фторидної кислоти | |
| 1.1.28. Які словосполучення побудовані правильно? | молекула води | іон Неону | атом кисню | молекула ортофо-фатної кислоти | |
| 1.1.29. Які словосполучення побудовані правильно? | молекула сірководню | іон літію | атом води | молекула силікатної кислоти | |
| 1.1.30. Знайдіть формулу, яка відповідає запису «два вільні атоми Сульфуру»: | 2S8 | 2SO3 | 2S | CS2 | |
| 1.1.31. Знайдіть запис, який відповідає формулі 2SO2: | два вільні атоми Оксигену | одна двоатомна молекула кисню | дві двоатомні молекули кисню | дві одноатомні молекули кисню | |
| 1.1.32. Знайдіть формулу, яка відповідає твердженню «Три двоатомні молекули водню»: | 3Н | NH3 | 3H2 | 3H2O | |
| 1.1.33. Знайдіть запис, який відповідає формулі: | чотири вільні атоми Фосфору | один вільний атом Фосфору | одна чотирьохатомна молекула фосфору | чотири чотирьохатомні молекули фосфору | |
| 1.1.34. Знайдіть формулу, яка відповідає твердженню «Дві двоатомні молекули фосфору»: | 2N2 | NH3 | 2N | 2H NO2 | |
| 1.1.35. Знайдіть запис, який відповідає формулі 2Na: | дві молекули натрію | одна молекула, що складається з двох атомів Натрію | дві молекули, що складаються з двох атомів Натрію | два вільні атоми Натрію | |
| 1.1.36. Знайдіть формулу, яка відповідає запису «Тривільні атоми Оксигену»: | 2СО2 | HN O3 | О3 | ЗО | |
| 1.1.37. За 1 а. о. м. прийнято: | 1/12 маси атома нукліду 12С | 1/12 маси природної суміші атомів нуклідів Карбону | 1/16 маси атома нукліду 16О | 1/14 маси атома нукліду 14N | |
| 1.1.38. Відносна атомна маса — це: | маса атома в грамах | маса атома в будь-яких умовних одиницях | відношення маси атома до маси 1/16 маси атома нукліду 16 О | відношення маси атома до маси 1/12 атома нукліду 12С | |
| 1.1.39.Відносна молекулярна маса - це: | відношення маси молекули до маси 1/12 атома нукліду 12С | маса молекули в будь-яких умовних одиницях | маса молекули в грамах | маса молекули в кисневих одиницях | |
| 1.1.40. У яких одиницях може бути виражена абсолютна маса атома речовини? | у міліграмах | у спеціальних умов-них одиницях маси | у грамах | у кілограмах | |
| 1.1.41.У яких одиницях може бути виражена абсолютна маса молекули речовини? | у міліграмах | у спеціальних умов-них одиницях маси | у грамах | у кілограмах | |
| 1.1.42. Кількість речовини не вимірюється в: | а.о.м. | г | моль | г/моль | |
| 1.1.43.Про поняття «моль» не можна сказати, що це: | маса однієї молекули | маса 6,02-1023 молекул | кількість часток в 1 молі речовини | кількість речовини, що містить 6,02 ·1023 частинок(атомів, молекул, йонів). | |
| 1.1.44. 1 моль - це: | одиниця вимірювання кількості речовини | кількість речовини, що містить 6,02 • 1023 структурних одиниць | маса 22,4 л газу (н.у.) | відношення маси речовини до її кількості | |
| 1.1.45.Молярна маса чисельно дорівнює масі: | однієї молекули речовини | 6,02-1023 структурних одиниць речовини | 22,4 л газу (н.у.) | 1 моль речовини | |
| 1.1.46.Укажіть одиницю молярної маси: | г | моль-1 | л/моль | моль | |
| 1.1.47.За нормальних умов 22,4 л - це: | 1 л води у вигляді пари | об'єм 3,01 • 1023 молекул газу | молярний об'єм будь-якого газу | об'єм 6,02 ·1023 молекул газу | |
| 1-1.48.Укажіть твердження, які справедливі для сталої Авогадро: | безрозмірна величина | одиниця вимірювання – моль -1 | чисельно дорівнює число атомів у 23 г натрію | чисельно дорівнює кількості молекул в 1 моль речовини. | |
| 1.1.49.За однакової маси та однакових зовнішніх умов для різних газів кількість молекул більша в тому газі, для якого: | менше значення молярної маси | більше значення молярної маси | більший об'єм, що його займає газ; | менший об'єм, що його займає газ | |
| 1.1.50.Укажіть речовини, для яких об'єм 1 моля за н. у. дорівнює 22,4 л: | вода | йод | кисень | азот | |
| 1.1.51. Укажіть одиницю вимірювання: | моль/л. | г/моль. | Л. | л/моль. | |
| 1.1.52.Укажіть гази, які є легшими за повітря: | озон | амоніак | метан | хлор | |
| 1.1.53.Укажіть гази, які є важчими за повітря: | водень | вуглекислий газ | азот | фтор | |
| 1.1.54.Зразки міді отримані різними способами з таких речовин: червоного Си2О, чорного CuO, білого CuSO4, си-нього CuSO4 · 5H2O, темно-зеленого (СиОН)2СО3 і темно- коричневого СиСl2. Чи відрізняються зразки міді один від одного за фізичними та хімічними властивостями? | так | ні | це залежить від спо-собу одержання міді | серед наведених відповідей нема жодної правильної | |
1.1.55. Внаслідок різних реакцій отримано воду:
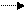 1) NaOH+HCl NaCl + H2O; 1) NaOH+HCl NaCl + H2O;
 2) CuSO4· 5H2O 2) CuSO4· 5H2O 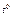 CuSO4+ 5H2O; CuSO4+ 5H2O;
 3) C2 H5OH 3) C2 H5OH 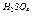 C2 H4+5H2O; C2 H4+5H2O;
 4) 2H2O2 O2+ 2H2O 4) 2H2O2 O2+ 2H2O
| після дистиляції вода має склад, однаковий в усіх випадках | після дистиляції вода має склад, різний в усіх випадках | після дистиляції вода має склад, однаковий у першому та другому випадках | після дистиляції вода має склад, однаковий у третьому та четвер-тому випадках |
Задачі по темі “ Початкові хімічні поняття „
Задачі
1. Визначте середню масу відповідних атома та молекули (в кг), якщо відомо, що маса атома Карбону-12 дорівнює 1,993∙10-26 кг (табл. 1)
Таблиця 1
| Варіант | Атом | Молекула | Варіант | Атом | Молекула |
| N | H2S | O | PH3 | ||
| Li | NH3 | Na | HCl | ||
| F | KBr | Si | CaCl2 | ||
| Mg | H2O | K | CCl4 | ||
| Be | HI | Cr | HF | ||
| P | MgS | B | BaCl2 | ||
| Ca | CH4 | S | LiF | ||
| Fe | AlCl3 | Al | SiH4 |
Розрахунок середньої маси молекули треба проводити за формулою:
m(молекули) =Мr(молекули)∙m(а. о. м.)
2. Для кожної сполуки визначте (табл. 2):
а) відносну молекулярну масу;
б) молярну масу;
в) масову частку хімічного елемента, позначеного в дужках.
Таблиця 2
| Варіант | Сполука | |||
| N2O5(N) | H2CO3(C) | NaOH(Na) | Na2SO4(S) | |
| Al2O3(Al) | HCl(H) | Sn(OH)2(Sn) | MgCO3(O) | |
| SnO(O) | HNO2(N) | KOH(H) | Na2SO4(Na) | |
| CaO(Ca) | HClO2(Cl) | Cr(OH)3(O) | NH4Cl(H) | |
| SO2(S) | H2SiO3(O) | Ba(OH)2(Ba) | Ca(HCO3)2(C) | |
| CO2(C) | Hl(H) | Mg(OH)2(Mg) | NaNO2(O) | |
| Fe2O3(O) | HClO3(Cl) | Sr(OH)2(H) | Ca3(PO4)2(Ca) | |
| Cl2O7(Cl) | HNO3(O) | Fe(OH)2(Fe) | Na2HPO4(H) | |
| Na2O(Na) | H2SO3(S) | CsOH(S) | BaS(Ba) | |
| Cr2O3(Cr) | HBr(H) | Al(OH)3(Al) | K2SiO3(O) | |
| B2O3(O) | HF(F) | LiOH(H) | NaCl(Na) | |
| Mn2O7(Mn) | H2SO4(O) | Fe(OH)2(Fe) | KClO3(Cl) | |
| PbO(Pb) | HClO4(O) | Zn(OH)2(H) | KBr(Br) | |
| CuO(Cu) | H3PO4(P) | Ca(OH)2(Ca) | Na2S2O3(Na) | |
| P2O5(P) | H2S(S) | Cu(OH)2(O) | Ca(H2PO4)2(O) | |
| SiO2(O) | HClO(H) | Pb(OH)2(Pb) | Cu(NO3)2(N) |
3. Розрахувати всі невідомі величини, вказані у табл. 3 (незаповнені графи), за відомими величинами (заповнені графи).
Таблиця 3.
| Варіант | Речовина | Кількість речовини V,моль | Маса газу m, г | Об’єм газу (н. у.) V, л | Кількість молекул газу |
| Сl2 | 0,1 | ||||
| N2 | 5,6 | ||||
| O2 | |||||
| H2 | 1,5∙1023 | ||||
| CH4 | |||||
| CO2 | |||||
| SO2 | 1,12 | ||||
| NH3 | 1,5 | ||||
| O3 | 3,01∙1023 | ||||
| HCl | 7,3 | ||||
| NO2 | 2,8 | ||||
| CO | 0,2 | ||||
| H2S | 9,03∙1023 | ||||
| PH3 | 3,4 | ||||
| F2 | 1,4 | ||||
| N2O | 2,0 |
4.Визначте число атомів кожного з елементів, які містяться в 5 моль води.
5. Визначте число атомів кожного з елементів, які містяться в 1,5 л
вуглекислого газу (н. у.).
6. Визначте, в якій кількості речовини сульфур(ІV) оксиду міститься таке число молекул, скільки атомів в 10 г кальцію.
7. Визначте, в якій кількості речовини гідроген хлориду НСl міститься таке число молекул, скільки атомів в 15 г натрію.
8. Змішали порошкоподібні метали: цинк масою 25 г, мідь масою 30 г і залізо масою 45 г. Визначте масову частку міді в отриманій суміші.
9. Визначте число атомів Ніколу у зразку сплаву нікелю з міддю масою 150 г, якщо масова частка нікелю в сплаві становить 20%.
10. У зразку сплаву міді зі сріблом число атомів Купруму дорівнює кількості атомів Аргентуму. Визначте масову частку міді в сплаві.
11. Визначте масові частки елементів у нітратній кислоті HNO3.
12. Визначте масові частки елементів у калій силікаті K2SiO3.
13. У якій сполуці масова частка Купруму більша: купрум(ІІ) оксиді СuO чи купрум (І) оксиді Сu2O? Відповідь підтвердіть розрахунками.
14. У якій сполуці масова частка Оксисену більша: нітроген(ІІ) оксиді NO чи нітроген(ІV) оксиді NO2? Відповідь підтвердіть розрахунками.
15. Кількість речовини калій оксиду К2О дорівнює 0,5 моль. Визначте масу кисню, необхідного для отримання цього зразка оксиду.
16. Кількість речовини натрій карбонату Na2CO3 дорівнює 0,8 моль. Визначте масу натрію, необхідного для отримання цього зразка карбонату.
17. Визначте відносну густину амоніаку за киснем та повітрям.
18. Визначте відносну густину вуглекислого газу за повітрям та воднем.
19. Визначте молярну масу газу, густина якого за воднем дорівнює 35,5.
20. Визначте масу 1 л (н. у.) таких газів: а) азоту N2; б) метану СН4 ;
в) кисню О2; г) чадного газу СО.
21. Визначте об’ємну частку азоту в суміші, яка містить 32 л азоту, 48 л
вуглекислого газу, 36 л гелію, 14 л водню (н. у.).
22. В суміші міститься 3,01∙1023 молекул кисню і 1,505∙1023 молекул азоту. Визначте об’ємні (н. у.) та масові частки компонентів суміші.
23. Визначте формулу речовини, якщо відомі масові частки елементів, що складають цю молекулу: ω(Сl)=92,21%, все інше становить Карбон.
24. Визначте формулу речовини, масова частка Карбону в якій дорівнює 84%, а Гідрогену 16%.
25. Масові частки Феруму та Сульфуру в сполуці дорівнюють 46,67% та
53,33%. Визначте формулу сполуки.
26. Масова частка Сульфуру в його оксиді в 1,5 рази менша за масову частку Оксисену. Визначте формулу сполуки.
27. Масові частки Натрію, Фосфору та Оксисену в сполуці дорівнюють 37,71%, 23,31% та 42,15%. Визначте формулу сполуки.
28. Нітроген утворює оксид, відносна густина якого за Гелієм дорівнює 19, а масова частка Оксисену 63,16%. Визначте формулу оксиду.
29. Масові частки Натрію, Силіцію та Оксисену в сполуці дорівнюють 37.71 %, 22,95% та 39,34%. Визначте формулу сполуки.
30. Масові частки Кальцію, Гідрогену, Фосфору та Оксисену в сполуці дорівнюють 29,40%, 0,74%, 22,80% та 47,06%. Визначте формулу сполуки.
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 1.3. Хімічні поняття і закони | | | Особливості розміщення електронів по орбіталях в атомах малих і великих періодів. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |