
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема 1.3. Хімічні поняття і закони
Лекція №4
Якщо два елементи утворюють між собою декілька сполук, то вагові кількості одного елемента, що сполучається з однією й тією ж ваговою кількістю іншого, співвідносяться між собою як невеликі цілі числа.
Закон кратних відношень
Елементи завжди сполучаються між собою у певних вагових співвідношеннях, що відповідають їх еквівалентам. Це означає, що склад будь-якої складної речовини може бути виражений цілими числами еквівалентів елементів, що входять до нього.
Закон еквівалентів легко пояснюється з точки зору атомно-молекулярного вчення. Під час хімічних реакцій атоми однієї речовини з'єднуються з певним числом атомів іншої речовини, а оскільки кожний атом характеризується постійною атомною масою, то масові відношення речовин, що вступають в реакцію, строго визначені.
У 1803 р. Д. Дальтоном був сформульований закон кратних відношень.
Цей закон підтвердив атомно-молекулярне вчення. Насправді, найменша кількість елемента, що вступає в реакцію — це атом. В реакцію може вступити тільки ціле число атомів, а не дробове. З закону кратних відношень випливає два висновки: 1)склад речовин (дальтонідів) змінюється стрибком, тому що в реакцію вступають цілі числа атомів; 2)кількість переходить в якість (веселящий газ N2О дуже відрізняється від безкольорової кристалічної речовини N2О5, що легко розкладається).
Класична ілюстрація закону кратних відношень — оксиди нітрогену (таблиця 1.2.1)
Таблиця 1.2.1.
| Назва та формула оксиду | Склад оксиду, % | Вагова частина О до 1 вагової частини N | Відносний ваговий вміст Оксигену | |
| Нітроген | Оксиген | |||
| Оксид нітрогену (І) N2О Оксид нітрогену (II) NO Оксид нітрогену (III), азотистий ангідрид N2О3 Оксид нітрогену (IV), діоксид нітpогену NO2 Оксид нітрогену (V), азотний ангідрид N2O5 | 63,6 46,7 36,8 30,4 25,9 | 36,4 53,3 63,2 69,6 74,1 | 0,57 1,14 1,71 2,28 2,85 |
Завдання для самоперевірки:
1. На прикладі підтвердити закон сталості складу, дати визначення
2Na+2H2O→2NaOH+H2
Na2O+H2O→2NaOH
2. Що таке еквівалент?
3. Задача. Еквівалент двохвалентного металу 20. Визначити, який це метал.
4. Задача. Визначте кількість речовини атомного бору, що міститься в тетрабораті натрію Na2B4O7 масою 40,4г (стор.7 Г.П.Хомченко).
1.Газові закони:
а) закон об’ємних відношень Гей-Люссака;
б) закон Авогадро;
в) закон Бойля-Маріотта;
г) закон Гей-Люссака;
д) об’єднаний газовий закон Бойля -Маріотта і Гей-Люссака;
е) рівняння стану ідеального газу – рівняння Клапейрона-Менделеєва.
1. Газові закони:
а) Закон обємних відношень Гей-Люссака.
Французький учений Ж.Л.Гей – Люссак встановив закон об’ємних відношень: об'єми газів, що вступають у реакцію за однакових умов (температура і тиск), відносяться між собою як прості цілі числа.
Наприклад, 1л хлору сполучається з 1 л водню, утворюючи 2л хлороводню; 2л оксиду сульфуру (ІV) сполучаються з 1л кисню, утворюючи 2л оксиду сульфуру (VІ).
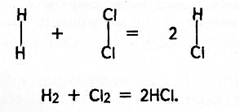 Цей закон дав змогу італійському вченому А. Авогадро припустити, що молекули простих газів (водню, кисню, азоту, хлору та інших) складаються з двох однакових атомів. Під час сполучення водню з хлором їх молекули розпадаються на атоми, а останні утворюють молекули хлороводню. Але оскільки з однієї молекули водню і однієї молекули хлору утворюються дві молекули хлороводню, то й об'єм останнього має дорівнювати сумі об'ємів вихідних газів, тобто
Цей закон дав змогу італійському вченому А. Авогадро припустити, що молекули простих газів (водню, кисню, азоту, хлору та інших) складаються з двох однакових атомів. Під час сполучення водню з хлором їх молекули розпадаються на атоми, а останні утворюють молекули хлороводню. Але оскільки з однієї молекули водню і однієї молекули хлору утворюються дві молекули хлороводню, то й об'єм останнього має дорівнювати сумі об'ємів вихідних газів, тобто
або
Отже, об'ємні відношення легко пояснюються, якщо виходити з уявлення про двохатомність молекул простих газів (Н2, Сl2, О2, N2 та інші). Це є, у свою чергу, доказом двохатомносгі молекул цих речовин.
б) Закон Авогадро;
Вивчення властивостей газів дало змогу А. Авогадро висунути гіпотезу, яка згодом була підтверджена дослідними даними, а тому названа законом Авогадро:
Читайте також:
- II. Поняття соціального процесу.
- IV. Закони ідеальних газів.
- V. Поняття та ознаки (характеристики) злочинності
- А/. Поняття про судовий процес.
- Аграрні закони України
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні провадження: поняття, класифікація, стадії
- Акти застосування юридичних норм: поняття, ознаки, види.
- Аналіз ступеня вільності механізму. Наведемо визначення механізму, враховуючи нові поняття.
- АРХІВНЕ ОПИСУВАННЯ: ПОНЯТТЯ, ВИДИ, ПРИНЦИПИ І МЕТОДИ
- Аудиторські докази: поняття та процедури отримання
- База управлінських рішень і закони організації.
| <== попередня сторінка | | | наступна сторінка ==> |
| Еквівалентна маса — це маса 1 еквівалента речовими (вимірюється у г-екв/моль). | | | В однакових об'ємах різних газів за однакових умов (температура і тиск) міститься однакова кількість молекул. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |