
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
S –, p –, d –, f – електрони.
Енергетична послідовність заповнення енергетичних підрівнів у багатоелектронних атомах
Характеристика стану електронів у атомі квантовими числами на прикладі 4р-підрівня
| Номер електрона | Значення квантового числа | |||
| n | l | m | ms | |
| +1 -1 +1 -1 | +1/2 +1/2 +1/2 -1/2 -1/2 -1/2 |
У багатоелектронних атомах зовнішні енергетичні підрівні можуть бути заповнені електронами не повністю, тобто виявитись недобудованими. Електрони та орбіталі таких підрівнів беруть участь в утворенні хімічних зв'язків.
У багатоелектронних атомах електрони розміщуються в нав-колоядерному просторі в послідовності поступового підвищення енергії. Енергія підрівнів зростає в міру збільшення головного квантового числа п та орбітального квантового числа l.
Відомий російський учений В. М. Клечковський запропонував два прості правила, згідно з якими відбувається заповнення енергетичних підрівнів електронами.
У міру збільшення заряду ядра атома послідовне заповнення електронних орбіталей починається від орбіталей з меншим значенням суми головного та орбітального квантових чисел (п + l) до орбіталей з більшим значенням цієї суми(перше правило Клечковського).
У разі однакових значень суми (n + l) заповнення орбіталей відбувається послідовно в міру збільшення значення головного квантового числа п (друге правило Клечковського).
Приклад послідовності заповнення енергетичних підрівнів у міру збільшення енергії наведений у табл. 2.1.2.
Таблиця 2.1.2.
| Значення суми (п + l) | Відповідне.сумі (п+ l) значення | Позначення підрівня | |
| п | l | ||
| 1s | |||
| 2s | |||
| 2р 3s | |||
| 3р 4s і | |||
| 3d 4р 5s | |||
| 4d 5р 6s | |||
| 4f 5d 6р 7s | |||
| 5f 6d |
Слід зазначити, що наведена енергетична послідовність заповнення підрівнів електронами не завжди повністю узгоджується з реальною для багатоелектронних атомів. Особливо значні відхилення спостерігаються для важких атомів. Однак з навчальною метою для написання електронно-конфігураційних формул атомів, а також під час вивчення періодичного закону та хімічних властивостей елементів залежно від електронної будови атомів ця послідовність цілком придатна для використання.
Розподіл електронів на підрівнях у багатоелектронних атомах використовується під час складання електронно-конфігураційних формул.
Складаючи такі формули, треба враховувати: загальне число електронів у атомі, яке дорівнює порядковому номеру елемента в періодичній системі; енергетичну послідовність заповнення підрівнів електронами; граничну електронну ємність підрівнів; підрівні одного рівня формують сумісно, але враховують енергетичну послідовність їх забудови. Наприклад, підрівень 4s (n+ l= 4 + 0 = 4) заповнюється електронами перед підрівнем 3d (n + l= 3 + 2 = 5), а в електронно-конфігураційній формулі його записують після нього; підрівень 6s (n + l= =6 + 0 = 6) заповнюється електронами перед підрівнем 4f (n + 2 = 4 + + 3 = =7), але його записують далеко за ним.
Як приклад наведемо електронно-конфігураційні формули елементів № 8 (кисень), № 20 (кальцій), № 26 (залізо), № 33 (арсен), № 60 (неодим):
8О 1s22s22p4
20Са 1s22s22p63s23p64s2
26Fe 1s22s22p63s23p63d64s2
33As 1s22s22p63s23p63d104s24p3
60Nd 1s22s22p63s23p63d104s24p64d104f45s25p66s2
(n+l) 1 2 3 3 4 5 4 5 6 7 5 6 6
Зупинимось на прикладі електронної конфігурації атома кальцію. Зауважимо, що після заповнення електронами 3p-підрівня атома кальцію далі забудовується 4s-, а не 3d-підрівень, оскільки сума n + l для 4s-підрівня дорівнює 4, а для 3d-підрівня — 5.
В атомі заліза формується 3d- підрівень, коли 4s-підрівень уже заповнений електронами. Це пов'язано з тим, що сума n + l для 4s-підрівня менша, ніж для 3d -підрівня, але всі підрівні одного рівня в цих конфігураціях потрібно записувати послідовно.
В атомі арсену заповнення підрівнів відбувається аналогічно атому заліза, а підрівень 3d записаний перед підрівнем 4s з тієї самої причини.
У досить складній формулі неодиму Nd заповнюється електронами 4f-підрівень. Його записують по порядку, разом з іншими підрівнями четвертого енергетичного рівня, хоча всі підрівні, що записані після нього (5s, 5p, 6s), мають менші значення суми (n + l) й, отже, заповнюються електронами раніше.
Повністю сформовані (заповнені електронами) енергетичні рівні в електронно-конфігураційних формулах іноді з метою скорочення позначають великими літерами, наприклад:
33As K L M 4s24p3.
Нагадаємо, що енергетичному рівню К відповідає електронна конфігурація 1s2, рівню L — 2s22p6, рівню М — 3s23p63d10.
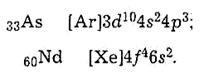 Застосовують також інший спосіб скороченого запису електронно-конфігураційних формул, у яких позначають електронні підрівні, що заповнюються, після хімічного символу попереднього інертного газу, взятого в квадратні дужки:
Застосовують також інший спосіб скороченого запису електронно-конфігураційних формул, у яких позначають електронні підрівні, що заповнюються, після хімічного символу попереднього інертного газу, взятого в квадратні дужки:
Для цього визначають різницю між числами електронів у атомі, що розглядається, й атомі попереднього інертного газу. Отримане число електронів розміщують на підрівнях, які мають забудовуватись далі..
В електронних конфігураціях можна позначати підрівні енергетичного рівня, що формується, на яких ще відсутні електрони і вони залишаються вакантними. Такі підрівні часто беруть участь в утворенні хімічних зв'язків:
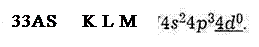 |
Якщо атом перетворюється на іон, то енергетична послідовність заповнення зовнішніх енергетичних підрівнів електронами змінюється. Тому електрони в процесі іонізації залишають ті підрівні, для яких головне квантове число п має максимальне значення:
 |
Під час вивчення хімічних властивостей елементів та їх здатності утворювати хімічні зв'язки користуються спрощеним схематичним зображенням атомів або їхніх зовнішніх енергетичних підрівнів, що забудовуються. У разі, коли на підрівні число електронів менше за граничне і можна по-різному їх розмістити, використовують правило Хунда:
| <== попередня сторінка | | | наступна сторінка ==> |
| Особливості розміщення електронів по орбіталях в атомах малих і великих періодів. | | | На підрівнях електрони розміщуються так, щоб сума їхніх спінових квантових чисел була максимальною. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |