
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
На підрівнях електрони розміщуються так, щоб сума їхніх спінових квантових чисел була максимальною.
Це пов'язано із взаємним відштовхуванням електронів, розміщених на підрівні. Електрони на вироджених орбіталях підрівня мають розміщуватись так, щоб взаємодіяти між собою з найменшою енергією, а це досягається за умови, що вони не спарюються. Утворення електронних пар енергетично невигідне і потребує затрати енергії, тому на схемі в усіх комірках заповнюваного підрівня спочатку розміщують по одному електрону, а вже далі вони починають спарюватися.
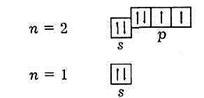 Як приклад наведемо повне електронно-графічне зображення атома кисню:
Як приклад наведемо повне електронно-графічне зображення атома кисню:
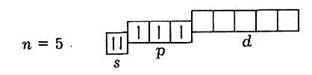
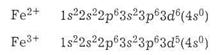 Частіше наводять електронно-графічне зображення тільки зовнішніх підрівнів, які беруть участь в утворенні хімічних зв'язків. Наприклад, для атома арсену:
Частіше наводять електронно-графічне зображення тільки зовнішніх підрівнів, які беруть участь в утворенні хімічних зв'язків. Наприклад, для атома арсену:
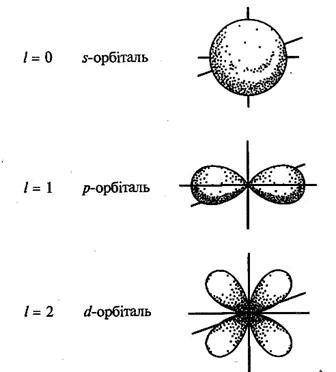
Кожному енергетичному рівню відповідає своя форма електронної хмари. Об'єм простору, де ймовірність знаходження електрона найбільша, називається електронною орбіталлю. Форма орбіталі збігається з формою електронної хмари і також залежить від побічного квантового числа:
 |
Структуру електронних оболонок можна зобразити за допомогою електронних, або квантових комірок — так званих графічних електронних формул. Кожна така комірка позначається кліткою: клітинка — орбіталь, стрілка — електрон, напрямок стрілки — напрямок спіну, вільна клітинка — вільна орбіталь, яку може займати електрон при збудженні. Знаючи будову електронних шарів, можна уявити структуру всієї електронної оболонки атома. Заповнюються вони згідно з певними правилами.
1. Електрони заповнюють електронні шари по мірі ослаблення притягання до ядра (від 1-го до наступних).
2. Заповнення електронами орбіталей кожного шару відбувається також по мірі ослаблення зв'язку з ядром: спочатку заповнюються s-орбіталі, потім наступні.
3. На кожній орбіталі може знаходитися не більше двох електронів.
4. Електрони заповнюють спочатку по одному, а якщо число електронів більше, ніж число орбіталей, то по два (у цьому випадку утворюються електронні пари).
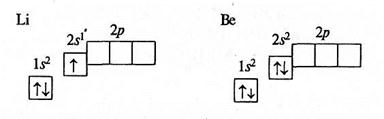
В атомі Літію Li третій, а в атомі Берилію Ве четвертий електрони розміщуються на другому енергетичному рівні. Ці електрони у своєму русі також утворюють сферичні хмари, але більшого розміру.
В атома Бору В з'являється п'ятий електрон. Цей електрон займає р-орбіталь.
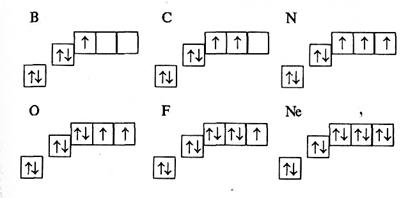 Подібні до гантелі p-електронні хмари розміщуються взаємно перпендикулярно по осях х, у, z.
Подібні до гантелі p-електронні хмари розміщуються взаємно перпендикулярно по осях х, у, z.
Зі схеми видно, що на одному й тому ж самому енергетичному рівні можуть знаходиться електрони з різною формою хмар, що відрізняються одна від одної величиною енергії зв'язку з ядром. Тому енергетичні рівні прийнято поділяти на підрівні. На першому енергетичному рівні є один s-підрівень, а на другому — два (s- та p-підрівні).
Ще більш складні форми, ніж p-орбіталь, мають d-орбіталі (їх п'ять) та f-орбиталі (їх сім).
3. Квантові числа та їх фізичний зміст.
У моделі, запропонованій Е.Резерфордом, електрони розглядались як частинки, що рухаються за плоскими орбітами навколо ядра. Згодом було доведено, що така картина не відповідає дійсності. Виявилось, що рух електронів та інших елементарних частинок не може бути відображений законами класичної механіки. Найбільш характерною особливістю електронів є подвійність їх поведінки, що полягає у здатності проявляти одночасно як властивості частинок, так і властивості хвиль. Подібно до частинок, електрони мають певну масу та заряд. Потік електронів виявляє хвильові властивості, наприклад характеризується здатністю до дифракції. На відміну від звичайних тіл для електрона не можна одночасно визначити його координати в атомі та швидкість. Електрон може знаходитися у будь-якій частині простору біля ядра, однак імовірність його знаходження у різних частинах цього простору неоднакова.
Читайте також:
- N – чисельність популяції
- S –, p –, d –, f – електрони.
- Аксіома неперервності дійсних чисел
- Алгоритми переведення чисел з однієї позиційної системи числення в іншу
- Аналіз чисельності, складу і руху персоналу
- Введення чисел.
- Визначення добутку на множині цілих невід’ємних чисел, його існування та єдиність. Операція множення та її основні властивості (закони).
- Визначення національних органів, на які покладається про ведення валютної політики, їхніх прав та обов’язків у цій сфері.
- Визначення суми на множині цілих невід’ємних чисел, її існування та єдиність. Операція додавання та її основні властивості (закони).
- Визначення чисельності окремих категорій працівників
- Визначення чисельності окремих категорій працівників
- Визначення чисельності окремих категорій працівників
| <== попередня сторінка | | | наступна сторінка ==> |
| S –, p –, d –, f – електрони. | | | Розподіл електронів за квантовими рівнями |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |