
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розподіл електронів за квантовими рівнями
Рис. 2.1.4. Форма електронної хмари в атомі Гідрогену
Простір поблизу ядра, в якому найімовірніше перебування електрона, називається орбіталлю.
Електрон наповнює простір навколо ядра. Він створює електронну хмару.
Електронна хмара не має строго обкреслених меж і густина її нерівномірна.
Стан єдиного електрона в атомі Гідрогену характеризується кулеподібною електронною хмарою, густина якої максимальна на відстані 0,053 нм від ядра. Отже, на цій відстані від ядра імовірність виявлення електрона максимальна, і цю відстань умовно приймають за радіус атома Гідрогену.
 |
Розміщуючись на різних відстанях від ядра, електрони утворюють електронні шари.
Кожному електронному шару відповідає певний рівень енергії електронів, що знаходяться на ньому, тому електронні шари називаються ще енергетичними рівнями.
Рівні нумерують, починаючи від ядра, та позначають прописними літерами латинського алфавіту: К,L, М, N,O, P, Q.
Число енергетичних рівнів в атомі хімічного елемента дорівнює номеру періоду в таблиці Менделєєва, в якому цей елемент розміщений.
Максимально можливе число електронів (N) на даному енергетичному рівні визначається за формулою
N= 2п2, де п — номер рівня.
У відповідності з цією формулою:
Ø на першому від ядра рівні максимально може бути два електрони;
Ø на другому — вісім електронів;
Ø на третьому — вісімнадцять електронів;
Ø на четвертому — тридцять два електрони.
Рівень, на якому знаходиться максимально можливе число електронів, називається завершеним.
Стан електрона в сучасній моделі атома визначається чотирма параметрами — квантовими числами.
Головне квантове число п визначає енергію електрона та ступінь його віддалення від ядра; воно приймає будь-які цілочислові значення, починаючи з 1 (п = 1, 2, 3,..., 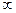 ). Історично енергетичним рівням атомів були надані позначення К,L, М, N,O, P, Q. Ці позначення використовуються й зараз паралельно із указанням значень головного квантового числа п. Так, K-оболонкою називають енергетичний рівень, для якого п = 1, L-оболонкою — енергетичний рівень з п = 2 і т. д.
). Історично енергетичним рівням атомів були надані позначення К,L, М, N,O, P, Q. Ці позначення використовуються й зараз паралельно із указанням значень головного квантового числа п. Так, K-оболонкою називають енергетичний рівень, для якого п = 1, L-оболонкою — енергетичний рівень з п = 2 і т. д.
Побічне (орбітальне або азимутальне) квантове число l визначає форму атомної орбіталі. Воно може набувати цілочислових значень від 0 до п - 1 (l=0, 1, ..., п - 1). Кожному значенню відповідає орбіталь особливої форми. При l =0 атомна орбіталь незалежно від значення головного квантового числа має сферичну форму (s-орбіталь). Значенню l= 1 відповідає атомна орбіталь, яка має форму гантелі (р-орбіталь). Ще більш складну форму мають орбіталі, які відповідають високим значенням /, що дорівнюють 2, 3 та 4 (d-, f-орбіталі).
Магнітне квантове число ml визначає положення атомної орбіталі у просторі відносно зовнішнього магнітного або електричного поля. Магнітне квантове число змінюється не довільним способом, а стрибком і пов'язане з орбітальним квантовим числом, змінюючись від + l до – l, включаючи 0. Отже, кожному значенню відповідає 2l+ 1 значень магнітного квантового числа.
Спінове квантове число тs може набувати лише двох можливих значень +1/2 та -1/2. Вони відповідають двом можливим та протилежним одне одному напрямкам власного магнітного моменту електрона.
Схема розподілу електронів за квантовими рівнями представлена в таблиці 2.1.5. Таблиця 2.1.5.
| Оболонка | Енерге-тичний рівень п | Енер-гети-чний підрі-вень l | Орбіталь | Сумар- на кількість орбіталей п2 | Граничне число електронів на енергетик-чних підрівнях | Граничне число електронів на енергетичних рівнях 2п2 | ||
| K | 0s | |||||||
| L | 0s 1p | +1, 0, -1 |
 1 1
|  2 2
| ||||
| M | 0s 1p 2d | +1, 0, -1 +2, +1, 0, -1,-2 |
 1 1
|  2 2
| ||||
| N | 0s 1p 2d 3f | +1, 0, -1 +2, +1, 0, -1,-2 +3,+2,+1,0, -1,-2,-3 |  1 1
|  2 2
|
Подібно до будь-якої системи, атоми прагнуть до мінімуму енергії. Це досягається при певному стані електронів, тобто при певному розподіленні електронів за орбіталями, яке можна оцінити на основі таких закономірностей.
Читайте також:
- I. Доповнення до параграфу про точкову оцінку параметрів розподілу
- IV. Розподіл нервової системи
- V. Розподільний диктант.
- Авоматизація водорозподілу регулювання за нижнім б'єфом з обмеженням рівнів верхнього б'єфі
- Автоматизація водорозподілу з комбінованим регулюванням
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Автоматизація водорозподілу регулювання зі сталими перепадами
- Автоматизація водорозподілу регулюванням з перетікаючими об’ємами
- Автоматизація водорозподілу регулюванням за верхнім б'єфом
- Автоматизація водорозподілу регулюванням за нижнім б'єфом
- Алгоритм розв’язання розподільної задачі
- Аналіз ефективності використання каналів розподілу
| <== попередня сторінка | | | наступна сторінка ==> |
| На підрівнях електрони розміщуються так, щоб сума їхніх спінових квантових чисел була максимальною. | | | Електронні конфігурації атомів перших двадцяти елементів періодичної системи Д. І. Менделeєва |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |